Aziridina
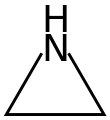
La aziridina es el compuesto de fórmula molecular C2H5N, cuya estructura corresponde a la de un ciclopropano con un grupo metileno sustituido por un átomo de nitrógeno. También se llaman así a los compuestos orgánicos que contienen el grupo funcional aziridina, al ser un heterociclo no aromático de tres miembros con un grupo amina (-NH-) y dos puentes de metileno (-CH2-) derivatizado.[3][4]
| Aziridina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Aziridina | ||
| General | ||
| Otros nombres |
azaciclopropano etilenamina | |
| Fórmula estructural |
 | |
| Fórmula molecular | C2H5N | |
| Identificadores | ||
| Número CAS | 151-56-4[1] | |
| ChEMBL | CHEMBL540990 | |
| KEGG | C11687 | |
| Propiedades físicas | ||
| Apariencia | Líquido aceitoso incoloro[2] | |
| Densidad | 8321 kg/m³; 8321 g/cm³ | |
| Masa molar | 4307 g/mol | |
| Punto de fusión | −77.9 | |
| Punto de ebullición | 56 °C (329 K) | |
| Propiedades químicas | ||
| Acidez | 7,9 pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
editarExisten muchas síntesis distintas de aziridinas. Cabe destacar las siguientes:
A partir de ciertas oximas se pueden obtener según esta síntesis con reactivos de Grignard[5][6][7][8]
Un grupo funcional amina desplaza el halogenuro adyacente en una reacción de sustitución nucleófila intramolecular para generar una aziridina. Los aminoalcoholes tienen la misma reactividad, pero el grupo hidroxilo primero se deben convertir en un buen grupo saliente. La ciclación de un aminoalcohol se denomina síntesis Wenker (1935),[9][10][11] y la de una haloamina método etilenimina de Gabriel (1888).[12]
- Síntesis de aziridinas de Blum-Ittah:
Implica una reacción en cascada que incluye la apertura del anillo de un epóxido con azida de sodio para formar un α-azidoalcohol. Este intermediario se hace reaccionar con trifenilfosfina, en donde se reduce la azida orgánica y se forma dinitrógeno y la aziridina:[13]
Reactividad
editarApertura nucleófila del anillo
editarLas aziridinas son sustratos muy reactivos con nucleófilos en reacciones de apertura del anillo debido a su tensión del anillo. Alcohólisis y aminólisis son básicamente las reacciones inversas de las ciclaciones. Nucleófilos de carbono tales como organolitiados y organocupratos también son eficaces.
Una aplicación de este tipo de reactividad es la empleada en la síntesis asimétrica del Tamiflu:
Cicloadición 1,3-dipolar
editarCiertas aziridinas N-sustituidas con grupos aceptores de electrones en ambos carbonos, forman iluros de azometina en una reacción de apertura de anillo térmica o fotoquímica.[14][15] Estos iluros pueden reaccionar con un dipolarófilo adecuado en una cicloadición 1,3-dipolar para obtener derivados de pirrolina:[16]
Cuando el grupo N-sustituyente es un grupo aceptor de electrones tal como un grupo tosilo, se rompe el enlace carbono-nitrógeno, formando otro zwitterión: TsN−–CH2–CH2+–R[17]
Véase también
editarReferencias
editar- ↑ Número CAS
- ↑ «Aziridine». Re-evaluation of Some Organic Chemicals, Hydrazine and Hydrogen Peroxide. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 71. 1999.
- ↑ Gilchrist, T.L. Heterocyclic chemistry. ISBN 0-582-01421-2.
- ↑ Epoxides and aziridines – A mini review Albert Padwaa and S. Shaun Murphreeb Arkivoc (JC-1522R) pp. 6–33 Online article
- ↑ Hoch, Compt. rend., 196, 1865 (1934); (a), ibid., aOS, 799 (1936); (e), ibid., 204, 358 (1937).
- ↑ Kenneth N. Campbell, James F. Mckenna (1939). «The action of Grignard reagents on oximes. i. The action of phenylmagnesium bromide on mixed ketoximes». J. Org. Chem. 4 (2): 198-205. doi:10.1021/jo01214a012.
- ↑ Kenneth N. Campbell, Barbara Knapp Campbell, Elmer Paul Chaput (1943). «The reaction of Grignard reagents with oximes. ii. The action of aryl grignard reagents with mixed ketoximes». J. Org. Chem. 8 (1): 99-102. doi:10.1021/jo01189a015.
- ↑ Kenneth N. Campbell, Barbara K. Campbell, James F. Mckenna, Elmer Paul Chaput (1943). «The action of Grignard reagents on oximes. iii. The mechanism of the action of arylmagnesium halides on mixed ketoximes. A new synthesis of ethyleneimines». J. Org. Chem. 8: 103-9. doi:10.1021/jo01189a016.
- ↑ Henry Wenker (1935). «The Preparation of Ethylene Imine from Monoethanolamine». Journal of the American Chemical Society 57 (1): 2328-2328. doi:10.1021/ja01314a504.
- ↑ A Modification of Wenker's Method of Preparing Ethyleneimine Philip A. Leighton, William A. Perkins, and Melvin L. Renquist J. Am. Chem. Soc.; 1947; 69(6) pp 1540 - 1540. (doi 10.1021/ja01198a512)
- ↑ Chemistry of Ethylenimine. VII. Cycloöctenimine or 9-Azabicyclo[6.1.0]nonane D. V. Kashelikar, Paul E. Fanta J. Am. Chem. Soc.; 1960; 82(18); 4927-4930. (doi 10.1021/ja01503a044)
- ↑ Gabriel Ethylenimine Method
- ↑ Ryan Hili, Andrei K. Yudin (2006). «Readily Available Unprotected Amino Aldehydes». J. Am. Chem. Soc. 128 (46): 14772-3. doi:10.1021/ja065898s.
- ↑ Harold W. Heine, Richard Peavy (1965). «Aziridines XI. Reaction of 1,2,3-triphenylaziridine with diethylacetylene dicarboxylate and maleic anhydride». Tetrahedron Letters 6 (35): 3123-6. doi:10.1016/S0040-4039(01)89232-7.
- ↑ Albert Padwa, Lewis Hamilton (1965). «Reactions of aziridines with dimethylacetylene dicarboxylate». Tetrahedron Letters 6 (48): 4363-7. doi:10.1016/S0040-4039(00)71101-4.
- ↑ Philippe Dauban, Guillaume Malik (2009). «A Masked 1,3-Dipole Revealed from Aziridines». Angew. Chem. Int. Ed. 48 (48): 9026-9. doi:10.1002/anie.200904941.
- ↑ Ioana Ungureanua, Cristian Bologab, Saïd Chayera, André Mann (16 de julio de 1999). «Phenylaziridine as a 1,3-dipole. Application to the synthesis of functionalized pyrrolidines». Tetrahedron Letters 40 (29): 5315-8. doi:10.1016/S0040-4039(99)01002-3.
Enlaces externos
editar- Wikimedia Commons alberga una categoría multimedia sobre Aziridina.