Capa electrónica
Una capa electrónica,[1] capa de electrones o cubierta de electrones designa a la distribución de un orbital alrededor del núcleo de un átomo. Cada capa puede contener un cierto número máximo de electrones y está asociada con un particular rango de energía en función de su distancia al núcleo. En un átomo estable, para que una cierta capa pueda contener o donar electrones, es necesario que todas las anteriores a ella estén completamente ocupadas. Los electrones en la capa poblada más externa, llamada capa de valencia y que es la única que puede encontrarse parcialmente vacía, determinan las propiedades químicas del átomo.[2]
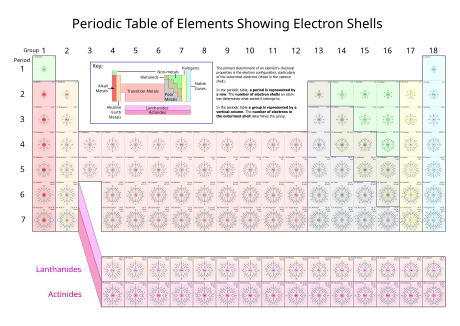
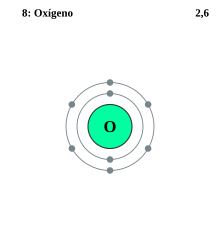
Cada capa puede contener solo un número fijo de electrones: la primera capa puede contener hasta dos electrones, la segunda capa puede contener hasta ocho (2 + 6) electrones, la tercera capa puede contener hasta 18 (2 + 6 + 10) y así. La fórmula general es que la capa n puede, en principio, contener hasta 2 (n2) electrones.[3] Para obtener una explicación de por qué existen electrones en estas capas, consulte configuración electrónica.[4]
Cada capa consta de una o más subcapas, y cada subcapa consta de uno o más orbitales atómicos.
Historia
editarEn 1913 Bohr propuso un modelo del átomo en el que se indicaba la disposición de los electrones en sus órbitas secuenciales. En aquel momento, Bohr permitió que la capacidad de la órbita interior del átomo aumentara hasta ocho electrones a medida que los átomos se hacían más grandes, y "en el esquema que se da a continuación el número de electrones de este anillo [exterior] se pone arbitrariamente igual a la valencia normal del elemento correspondiente". Utilizando estas y otras restricciones, propuso configuraciones que concuerdan con las que ahora sólo se conocen para los seis primeros elementos. "De lo anterior nos lleva al siguiente esquema posible para la disposición de los electrones en los átomos ligeros:"[5][6]
La existencia de capas de electrones fue observada por primera vez en el rayo X de Charles Barkla y Henry Moseley. Barkla las llamó con las letras K, L, M, N, O, P, y Q.[7] El origen de esta terminología fue alfabético. Una capa J fue sospechada, pero otros experimentos indicaron que las líneas de absorción de K eran producidas por la primera capa de electrones.
El nombre de las capas de electrones se deriva del modelo de Bohr, en el cual se pensaba que los grupos de electrones orbitaban el núcleo a ciertas distancias, así que sus órbitas formaban capas alrededor de los núcleos.
El fisicoquímico Gilbert Lewis fue responsable del desarrollo temprano de la teoría de la participación de los electrones de la capa de valencia en los enlaces químicos. Linus Pauling después generalizó y expandió la teoría al aplicar nociones de la mecánica estructural.
| Elemento | Electrones por capa | Elemento | Electrones por capa | Elemento | Electrones por capa |
|---|---|---|---|---|---|
| 1 | 1 | 9 | 4, 4, 1 | 17 | 8, 4, 4, 1 |
| 2 | 2 | 10 | 8, 2 | 18 | 8, 8, 2 |
| 3 | 2, 1 | 11 | 8, 2, 1 | 19 | 8, 8, 2, 1 |
| 4 | 2, 2 | 12 | 8, 2, 2 | 20 | 8, 8, 2, 2 |
| 5 | 2, 3 | 13 | 8, 2, 3 | 21 | 8, 8, 2, 3 |
| 6 | 2, 4 | 14 | 8, 2, 4 | 22 | 8, 8, 2, 4 |
| 7 | 4, 3 | 15 | 8, 4, 3 | 23 | 8, 8, 4, 3 |
| 8 | 4, 2, 2 | 16 | 8, 4, 2, 2 | 24 | 8, 8, 4, 2, 2 |
La terminología de cáscara o capa proviene de la modificación de Arnold Sommerfeld del modelo de Bohr de 1913. Durante este periodo Bohr estaba trabajando con Walther Kossel, cuyos artículos de 1914 y 1916 llamaban a las órbitas "cáscaras".[8][9] Sommerfeld conservó el modelo planetario de Bohr, pero añadió órbitas ligeramente elípticas (caracterizadas por números cuánticos adicionales l y m) para explicar la fina estructura espectroscópica de algunos elementos.[10] Los múltiples electrones con el mismo número cuántico principal (n) tenían órbitas cercanas que formaban una "cáscara" de espesor positivo en lugar de la órbita circular del modelo de Bohr cuyas órbitas llamadas "anillos" estaban descritas por un plano.[11]
La existencia de cáscaras de electrones se observó experimentalmente por primera vez en los estudios de absorción de rayos X de Charles Barkla y Henry Moseley. El trabajo de Moseley no se refería directamente al estudio de las cáscaras de electrones, porque estaba tratando de demostrar que la tabla periódica no estaba ordenada por peso, sino por la carga de los protones en el núcleo.[12] Sin embargo, dado que el número de electrones en un átomo eléctricamente neutro es igual al número de protones, este trabajo fue extremadamente importante para Niels Bohr, quien mencionó el trabajo de Moseley varias veces en su entrevista de 1962.[13] Moseley formaba parte del grupo de Rutherford, al igual que Niels Bohr. Moseley midió las frecuencias de los rayos X emitidos por cada elemento entre el calcio y el zinc y descubrió que las frecuencias eran mayores a medida que los elementos se hacían más pesados. Esto condujo a la teoría de que los electrones emitían rayos X cuando se desplazaban a capas inferiores.[14] Esto llevó a la conclusión de que los electrones estaban en las envolturas de Kossel con un límite definido por envoltura, etiquetando las envolturas con las letras K, L, M, N, O, P y Q.[6][15] El origen de esta terminología fue alfabético. Barkla, que trabajaba independientemente de Moseley como experimentalista de espectrometría de rayos X, observó por primera vez en 1909 dos tipos distintos de dispersión al disparar rayos X a elementos y los denominó "A" y "B". Barkla describió estos dos tipos de difracción de rayos X: el primero era ajeno al tipo de material utilizado en el experimento y podía polarizarse. El segundo haz de difracción lo denominó "fluorescente" porque dependía del material irradiado.[16] En aquel momento no se sabía qué significaban estas líneas, pero en 1911 Barkla decidió que podría haber líneas de dispersión anteriores a la "A", así que empezó por la "K".[17] Sin embargo, experimentos posteriores indicaron que las líneas de absorción K son producidas por los electrones más internos. Más tarde se descubrió que estas letras correspondían a los valores de n 1, 2, 3, etc. que se utilizaron en el modelo de Bohr. Se utilizan en la notación de Siegbahn espectroscópica.
El trabajo de asignar electrones a conchas fue continuado de 1913 a 1925 por muchos químicos y unos pocos físicos. Niels Bohr fue uno de los pocos físicos que siguieron el trabajo de los químicos[18] de definir la tabla periódica, mientras que Arnold Sommerfeld trabajó más en intentar hacer un modelo de trabajo relativista del átomo que explicara la estructura fina de los espectros desde el punto de vista de la física orbital clásica a través del enfoque Atombau.[6] Einstein y Rutherford, que no seguían la química, desconocían a los químicos que estaban desarrollando teorías de la corteza electrónica de la tabla periódica desde el punto de vista de la química, como Irving Langmuir, Charles Bury, J. J. Thomson, y Gilbert Lewis, que introdujeron correcciones al modelo de Bohr como un máximo de dos electrones en la primera capa, ocho en la siguiente y así sucesivamente, y fueron responsables de explicar la valencia en las capas externas de electrones, y la construcción de átomos añadiendo electrones a las capas externas.[19][6] Así que cuando Bohr esbozó su teoría atómica de las capas de electrones en 1922, no había ninguna fórmula matemática para la teoría. Así que Rutherford dijo que le resultaba difícil "formarse una idea de cómo llega a sus conclusiones".[20][21] Einstein dijo del artículo de Bohr de 1922 que sus "cáscaras electrónicas de los átomos junto con su significado para la química me parecieron un milagro, y me parecen un milagro incluso hoy en día".[22] Arnold Sommerfeld, que había seguido la estructura Atombau de los electrones en lugar de Bohr, que estaba familiarizado con los puntos de vista de los químicos sobre la estructura de los electrones, habló de la conferencia de Bohr de 1921 y del artículo de 1922 sobre el modelo de la cáscara como "el mayor avance en la estructura atómica desde 1913".[6][23][20] Sin embargo, el desarrollo de la capa de electrones de Niels Bohr era básicamente la misma teoría que la del químico Charles Rugeley Bury en su artículo de 1921.[24][6][25]
Mientras se seguía trabajando en la estructura de la cáscara del electrón del Modelo Sommerfeld-Bohr, Sommerfeld había introducido tres "números cuánticos n, k y m, que describían el tamaño de la órbita, la forma de la órbita y la dirección en la que apuntaba la órbita"[26] Como usamos k para la constante de Boltzmann, el número cuántico azimutal se cambió a ℓ. Cuando se propuso la teoría mecánica cuántica moderna basada en la mecánica matricial de Heisenberg y la ecuación de onda de Schrödinger, estos números cuánticos se mantuvieron en la teoría cuántica actual pero se cambiaron a n siendo el número cuántico principal, y m siendo el número cuántico magnético.
Sin embargo, la forma final del modelo de cáscara de electrones que todavía se usa hoy en día para el número de electrones en las cáscaras fue descubierta en 1923 por Edmund Stoner, que introdujo el principio de que la cáscara n estaba descrita por 2(n2). Véase esto en 1925, Wolfgang Pauli añadió un cuarto número cuántico, "spin", durante el período de la teoría cuántica antigua del átomo del Sistema Solar Sommerfeld-Bohr para completar la teoría moderna de la cáscara del electrón.[6]
Simbología
editarLas capas electrónicas son numeradas correlativamente, partiendo de la más cercana al núcleo, y se identifican mediante letras:
- Capa K, n = 1, es la más interior, presente en todos los elementos químicos.
- Capa L, n = 2
- Capa M, n = 3
- Capa N, n = 4
- Capa O, n = 5
Número de electrones
editarEl número máximo de electrones que puede contener una capa n es 2n² (hasta la capa N).
- Número de electrones por capa
- (1ª) Capa K hasta 2 electrones
- (2ª) Capa L hasta 8 electrones
- (3ª) Capa M hasta 18 electrones
- (4ª) Capa N hasta 32 electrones
- (5ª) Capa O hasta 32 electrones
La cantidad de capas de un átomo depende de su número total de electrones. Los electrones se disponen con prioridad en la capa más cercana al núcleo hasta que esta se satura (se alcanza su número máximo de electrones), los electrones restantes se colocan en la siguiente capa hasta que está saturada y así sucesivamente, hasta que ya no hay electrones. Por lo tanto, un átomo de hidrógeno, que tiene un electrón, solo tiene una capa, la capa K que está parcialmente llena (un electrón de un máximo de dos). En un átomo de helio, que tiene dos electrones, ambos se distribuyen en la capa K que queda completamente llena (dos electrones de un máximo de dos). Por lo tanto, el átomo de litio, que tiene tres electrones, tiene una capa K saturada (con los dos primeros electrones), y una capa L que contiene el tercer electrón.
Los primeros elementos que tendrían más de 32 electrones en una capa pertenecerían al bloque g del período 8 de la tabla periódica. Estos elementos tendrían algunos electrones en su subcapa de 5g y, por lo tanto, tendrían más de 32 electrones en la capa O (quinta capa electrónica principal).
Subcapas
editarCada capa se compone de una o más subcapas, que a su vez se componen de los orbitales atómicos. Por ejemplo, la primera capa (K) tiene una subcapa, llamada 1s; la segunda capa (L) tiene dos subniveles, llamados 2s y 2p; la tercera capa (M) tiene 3s, 3p y 3d; la cuarta (N) tiene las subcapas 4s, 4p, 4d y 4f; la quinta capa (O) tiene 5s, 5p, 5d y 5f y teóricamente puede contener más. Los diversos subniveles posibles se muestran en la siguiente tabla:
| Etiqueta de subcapa |
ℓ | Número máx. electrones |
Capas conteniéndolo | Nombre histórico |
|---|---|---|---|---|
| s | 0 | 2 | Cada capa | sharp [‘aguda’] |
| p | 1 | 6 | 2ª capa y superiores | principal [‘principal’] |
| d | 2 | 10 | 3ª capa y superiores | diffuse [‘difusa’] |
| f | 3 | 14 | 4ª capa y superiores | fundamental [‘fundamental’] |
| g | 4 | 18 | 5ª capa y superiores (teóricamente) | (la siguiente en orden alfabético después de la f)[27] |
Ejemplo
editarEl sodio tiene once electrones. Su estructura electrónica es la siguiente:(K)2 (L)8 (M)1. Las capas K y L están saturadas.
El número máximo de electrones permitidos en cada capa no es cualquiera. Según el principio de Pauli, es igual a 2n² para la nésima capa. Se completará con 2 electrones en la capa K, 8 en la capa L, 18 en la M, etc. En resumen:(K)2(L)8(M)18(N)32(O)50(P)72 ...
Este modelo de llenado de las capas electrónicas ha sido cuestionado por la física cuántica con un modelo más complejo, pero que parece más próximo a la realidad a escala atómica: además de las capas, debe tenerse en cuenta la existencia de subcapas electrónicas denominadas s, p, d, f, g, y que tienen sus propios números máximos de electrones para estar saturadas.
Las cosas se complican desde el átomo de potasio (Z = 19): El 19e electrón se coloca en la capa de N, mientras que la capa M no está saturada (puede contener 18 electrones, a pesar de que solo contiene 8).
Así, para el átomo de potasio, tenemos:(K)2(L)8(M)8(N)1 en lugar de (K)2(L)8(M)9.
Lo mismo ocurre con el átomo de calcio (Z = 20), pero para los átomos con un número atómico entre el 20 y 30, los 20.ésimos a 30.ésimos electrones se colocan en la capa M, que terminan de llenar antes de llenar la capa N.
Véase también
editarReferencias
editar- ↑ Macy, Rudolph (1 de enero de 1976). Química orgánica simplificada. Reverte. ISBN 9788429173314. Consultado el 15 de diciembre de 2015.
- ↑ Society, American Chemical (2005). Química, un proyecto de la A.C.S.. Reverte. ISBN 9788429170016. Consultado el 4 de octubre de 2019.
- ↑ Re: Why do electron shells have set limits ? madsci.org, 17 March 1999, Dan Berger, Faculty Chemistry/Science, Bluffton College
- ↑ Electron Subshells. Corrosion Source.
- ↑ Bohr, N. (1913). «Sobre la constitución de átomos y moléculas, Parte II. Sistemas que contienen un solo núcleo». Philosophical Magazine 26: 476-502.
- ↑ a b c d e f g Kragh, Helge. "La segunda teoría atómica de Niels Bohr". Historical Studies in the Physical Sciences, vol. 10, University of California Press, 1979, pp. 123-86, https://doi.org/10.2307/27757389.
- ↑ Macy, Rudolph (1976). Química orgánica simplificada. Reverte. ISBN 9788429173314. Consultado el 4 de octubre de 2019.
- ↑ W. Kossel, "Über Molekülbildung als Folge des Atombaues", Ann. Phys., 1916, 49, 229-362 (237).
- ↑ Traducido en Helge Kragh, Aarhus, LARS VEGARD, ATOMIC STRUCTURE, AND THE PERIODIC SYSTEM, Bull. Hist. Chem., VOLUME 37, Number 1 (2012), p.43.
- ↑ Donald Sadoway, Introduction to Solid State Chemistry, Lecture 5 Archivado el 29 de junio de 2011 en Wayback Machine.
- ↑ Bohr, Niels (1913). On the Constitution of Atoms and Molecules, Part I. _Philosophical Magazine_ 26:1--25.
- ↑ Uhler, Horace Scudder. "Sobre la ley de Moseley para los espectros de rayos X". Proceedings of the National Academy of Sciences of the United States of America, vol. 3, nº 2, National Academy of Sciences, 1917, pp. 88-90, http://www.jstor.org/stable/83748.
- ↑ Entrevista a Niels Bohr 1962 Sesión III https://www.aip.org/history-programs/niels-bohr-library/oral-histories/4517-3
- ↑ Kumar, Manjit. Quantum: Einstein, Bohr y el gran debate sobre la naturaleza de la realidad / Manjit Kumar.-1ª ed. americana, 2008. Chap.4.
- ↑ Barkla, Charles G. (1911). «XXXIX. Los espectros de las radiaciones fluorescentes de Röntgen». Philosophical Magazine. Series 6 22 (129): 396-412. doi:10.1080/14786440908637137. «Anteriormente denotadas por las letras B y A (...). Las letras K y L son, sin embargo, preferibles, ya que es muy probable que existan series de radiaciones tanto más absorbibles como más penetrantes.»
- ↑ Michael Eckert, Disputed discovery: the beginnings of X-ray diffraction in crystals in 1912 and its repercussions, enero de 2011, Acta crystallographica. Section A, Foundations of crystallography 68(1):30-39 Este artículo del centenario de Laue también se ha publicado en Zeitschrift für Kristallographie [Eckert (2012). Z. Kristallogr. 227 , 27-35].
- ↑ Charles G. Barkla M.A. D.Sc. (1911) XXXIX. The spectra of the fluorescent Röntgen radiations, The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 22:129, 396-412, DOI: 10.1080/14786440908637137
- ↑ T.Hirosigey S.Nisio, "Formation of Bohr's Theory of Atomic Constitution",Jap. Stud.Hist.Set, Nº 3(1964),6-28.
- ↑ Véase la Tabla Periódica para una historia completa.
- ↑ a b Niels Bohr Collected Works, Vol. 4, p. 740. Postal de Arnold Sommerfeld a Bohr, 7 de marzo de 1921.
- ↑ Pais, Abraham (1991), Niels Bohr's Times, in Physics, Philosophy, and Polity (Oxford: Clarendon Press), citado p. 205.
- ↑ Schilpp, Paul A. (ed.) (1969), Albert Einstein: Philosopher-Scientist (Nueva York: MJF Books). Colección publicada por primera vez en 1949 como Vol. VII de la serie The Library of Living Philosophers por Open Court, La Salle, IL, Einstein, Albert 'Autobiographical Notes', pp.45-47. .
- ↑ Kumar, Manjit. Quantum: Einstein, Bohr y el gran debate sobre la naturaleza de la realidad / Manjit Kumar.-1ª ed. americana, 2008. Chap.7.
- ↑ Bury, Charles R. (julio de 1921). "Teoría de Langmuir sobre la disposición de los electrones en átomos y moléculas". Revista de la Sociedad Química Americana. 43 (7): 1602–1609. doi:10.1021/ja01440a023. ISSN 0002-7863.
- ↑ The Genesis of the Bohr Atom, John L. Heilbron y Thomas S. Kuhn, Historical Studies in the Physical Sciences, Vol. 1 (1969), pp. vi, 211-290 (81 páginas), University of California Press,p. 285-286.
- ↑ Kumar, Manjit. Quantum: Einstein, Bohr y el gran debate sobre la naturaleza de la realidad / Manjit Kumar.-1ª ed. americana, 2008. Cap.5.
- ↑ Jue, T. (2009). «Quantum Mechanic Basic to Biophysical Methods». Fundamental Concepts in Biophysics (en inglés). Berlín: Springer. p. 33. ISBN 1-58829-973-2.
Enlaces externos
editar- Esta obra contiene una traducción derivada de «Couche électronique» de Wikipedia en francés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Wikimedia Commons alberga una galería multimedia sobre capas electrónicas.