Oxalato de sodio
El oxalato de sodio o etanodiato de sodio es una sal sódica derivada del ácido oxálico.
| Oxalato de sodio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Etanodioato de sodio | ||
| General | ||
| Otros nombres | Sal disódica del ácido oxálico | |
| Fórmula semidesarrollada | NaOOC-COONa | |
| Fórmula estructural |
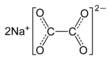 | |
| Fórmula molecular | Na2C2O4 | |
| Identificadores | ||
| Número CAS | 62-76-0[1] | |
| ChEBI | 132764 | |
| ChEMBL | CHEMBL182928 | |
| ChemSpider | 5895 | |
| PubChem | 517020 6125, 517020 | |
| UNII | 7U0V68LT9X | |
| Propiedades físicas | ||
| Apariencia | sólido, cristales monoclínicos incoloros | |
| Densidad | 2340 kg/m³; 2,34 g/cm³ | |
| Masa molar | 134.00 g mol−1 g/mol | |
| Punto de descomposición | 533,15 K (260 °C) | |
| Estructura cristalina | Monoclinal | |
| Propiedades químicas | ||
| Solubilidad en agua |
3.7 g/100 mL (20 °C) 6.25 g/100 mL (100 °C) Solubilidad en otros compuestos = insoluble en etanol y éter dietílico[2] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Su fórmula molecular es Na2C2O4 y su fórmula desarrollada NaOOC-COONa.
Se agrupa en la función química de los oxalatos.
Propiedades
editarEl oxalato de sodio es un polvo blanco no higroscópico moderadamente soluble en agua. Cristaliza en el sistema cristalino monoclínico en el grupo espacial P21/a.[3]
A los 290 °C comienza a descomponerse en carbonato de sodio y monóxido de carbono.[4]
La entalpía de disolución del oxalato de sodio a 298,15 K es de 13,86 kJ·mol−1.[5]
En la naturaleza el oxalato de sodio se encuentra en una forma mineral muy rara denominada natroxalato.
Fabricación
editarPuede prepararse por reacción entre el ácido oxálico y el hidróxido de sodio.
A gran escala se produce a partir del formiato de sodio a una temperatura superior a los 360 °C.
También se obtiene como un residuo del proceso Bayer (que produce hidróxido de aluminio 'hidrato de alúmina').[2]
Usos
editarSe puede utilizar con sulfuro de manganeso(II) para el ajuste de disoluciones estándar, como patrón primario, para disoluciones de permanganato de potasio (ver también manganometría). Es deseable que la temperatura de valoración sea mayor a 60 °C para asegurar que todo el permanganato añadido reaccione rápidamente. La cinética de la reacción es compleja, y los iones manganeso(II) formados catalizan la reacción subsecuente entre el permanganato y el ácido oxálico (formado "in situ" mediante la adición de un exceso de ácido sulfúrico). La ecuación final es como sigue:[6]
- 5H2C2O4 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 10CO2 + 8H2O
Además puede utilizarse como colorante en la pirotecnia (amarillo / naranja). En la metalurgia es, por ejemplo, utilizado durante la tostación de minerales de vanadio en horno rotatorio (reacción de pentóxido de vanadio a vanadato de sodio). En otras aplicaciones se utiliza como auxiliar en la industria textil y como ingrediente en cementos especiales.
Actividad biológica
editarComo otros muchos oxalatos, el oxalato de sodio es tóxico para los seres humanos. Puede causar quemaduras dolorosas en la boca, la garganta y el estómago, vómito sangriento, dolor de cabeza, calambres musculares y convulsiones, caída de la presión sanguínea, fallo cardíaco, choque, coma y posiblemente la muerte. La dosis letal mediana por ingesta de oxalatos es de 10 a 15 g (según la MSDS).
El oxalato de sodio, como los citratos, puede utilizarse para extraer iones calcio (Ca2+) del plasma sanguíneo. También previene la coagulación de la sangre. Téngase en cuenta que mediante la eliminación de los iones de calcio de la sangre, el oxalato de sodio puede dañar la función cerebral, y el oxalato de calcio puede depositarse en los riñones.
Referencias
editar- ↑ Número CAS
- ↑ a b Ullrich Jahn, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ J. Lowe, M. Ogden, A. McKinnon, G. Parkinson: "Crystal growth of sodium oxalate from aqueous solution" in Journal of Crystal Growth 2002, 237-239, S. 408-413. doi 10.1016/S0022-0248(01)01864-4
- ↑ T. Yoshimori, Y. Asano, Y. Toriumi and T. Shiota: "Investigation on the drying and decomposition of sodium oxalate" in Talanta 1978, 25(10), S. 603-605. doi 10.1016/0039-9140(78)80158-1
- ↑ M. Z. H. Rozaini, P. Brimblecombe: "The solubility measurements of sodium dicarboxylate salts; sodium oxalate, malonate, succinate, glutarate, and adipate in water from T = (279.15 to 358.15) K" in The Journal of Chemical Thermodynamics 2009, 41(9), S. 980-983. doi 10.1016/j.jct.2009.03.017
- ↑ Mcbride, R. S. (1912). «The standardization of potassium permanganate solution by sodium oxalate». J. Am. Chem. Soc. 34: 393. doi:10.1021/ja02205a009.