Peptidomimético
Un péptidomimético es una estructura similar a la proteína, diseñada para imitar un péptido, capaz de reemplazarlo en sus interacciones con receptores y enzimas.[1] Por lo general, surgen típicamente de la modificación de un péptido ya existente, o del diseño de sistemas similares que imitan péptidos, como los peptoides y los péptidos β, para alterar las propiedades de la molécula. Por ejemplo, pueden surgir de modificaciones para cambiar la estabilidad de la molécula o su actividad biológica, y ello puede desempeñar un papel en el desarrollo de compuestos farmacológicos a partir de los péptidos existentes. Estas modificaciones implican cambios sobre los péptidos que no suceden de forma natural (como alteraciones en la columna vertebral y la incorporación de aminoácidos no naturales). Según su similitud con el péptido precursor, los peptidomiméticos se pueden agrupar en cuatro clases (A - D) donde A presenta la mayor cantidad de similitudes y D. Las clases A y B involucran andamios similares a péptidos, mientras que las clases C y D incluyen moléculas pequeñas (Figura 1).[2]
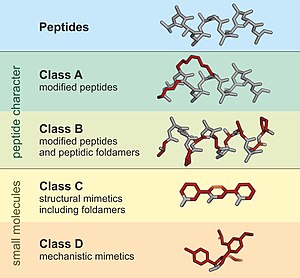
Estructura
editarLos peptidomiméticos son un grupo químicamente heterogéneo de compuestos orgánicos de bajo peso molecular. A pesar de una gran cantidad de cambios, generalmente se puede observar una similitud estructural más o menos pronunciada con los péptidos.
Las modificaciones de la cadena principal del péptido incluyen, en particular, un intercambio de los grupos péptido amida por grupos bioisostéricos. Las modificaciones simples del esqueleto del péptido también incluyen alquilaciones del nitrógeno de la amida. Numerosos peptidomiméticos incluyen ciclaciones que se han introducido con el propósito de restricción conformacional y estabilización de la estructura tridimensional.
D-péptidos
editarUn D-péptido es una pequeña secuencia de D-aminoácidos. Dado que los ribosomas son específicos de los L-aminoácidos, los D-péptidos rara vez se encuentran naturalmente en los organismos y no se digieren ni degradan fácilmente. Los peptidomiméticos D-péptidos diseñados para imitar los L-péptidos naturales comúnmente tienen propiedades terapéuticas. Las enzimas responsables de la hidrólisis de péptidos no tendrán una alta afinidad por los D-péptidos dada la estereoquímica inversa de los péptidos que se encuentran normalmente en el cuerpo. También tienen una respuesta inmune débil, disminuyendo la inflamación.[3]
β-péptidos
editarLos β-péptidos son péptidos que tienen dos carbonos entre el carbonilo de la amida y el nitrógeno de la amida precedente. La estructura helicoidal sería más estable que en los péptidos normales.[4]
Peptoides
editarEn general, los peptidomiméticos están hechos para imitar ciertos péptidos activos mientras tienen una vida media más larga en el cuerpo o una mayor afinidad.
Ejemplos
editarLos enfoques peptidomiméticos se han utilizado para diseñar moléculas pequeñas que matan selectivamente las células cancerosas, un enfoque conocido como quimioterapia dirigida, al inducir la muerte celular programada mediante un proceso llamado apoptosis. Los siguientes dos ejemplos imitan las proteínas involucradas en las interacciones proteína-proteína clave que reactivan la vía apoptótica en el cáncer pero lo hacen por mecanismos distintos.
En 2004, Walensky y sus colaboradores informaron sobre un péptido alfa helicoidal estabilizado que imita las proteínas pro-apoptóticas.[5] Esta molécula fue diseñada para estabilizar la estructura helicoidal nativa formando un macrociclo entre cadenas laterales que no están involucradas en la unión. Este proceso, denominado péptido engrapado, utiliza aminoácidos no proteinogénicos para facilitar la macrociclación mediante la metátesis de olefina de cierre de anillo.[6]
Los heterociclos se usan a menudo para imitar el enlace amida de los péptidos. Los tiazoles, por ejemplo, se encuentran en péptidos naturales y los investigadores los utilizan para imitar el enlace amida del péptido.
Como análogos resistentes a la escisión de sustratos enzimáticos, los peptidomiméticos se usan como inhibidores enzimáticos. Un conocido ligando de receptor peptidomimético es la morfina de la adormidera, que es un análogo de la secuencia peptídica de las endorfinas del cuerpo y activa los receptores opioides. Debe su acción analgésica a que es capaz de unirse a los receptores de unos péptidos llamados encefalinas.
Usos
editar| Peptidomiméticos | Péptidos o proteínas análogos | Secuencia peptídica estructuralmente análoga | Proteína objetivo | Uso |
|---|---|---|---|---|
| IECA (Ej. Captopril)[7] |
BPP5a | DKWAP | ECA | Terapia para la presión arterial alta y la insuficiencia cardíaca crónica. |
| HIV-Inhibidor de proteasa (Ej. Saquinavir)[8] |
productos genéticos gag-pol | LNFP | Proteasa HIV | Tratamiento de infecciones por VIH. |
| Opioide (Ej. Fentanilo)[9] |
Endorfina | YGGF | Receptores opiodes | Tratamiento del dolor moderado y severo. |
| Inhibidores de la renina (Ej. Zankiren) |
Angiotensinógeno | PFHLV | Renina | Tratamiento de la hipertensión arterial. |
| Inhibidores de la trombina (Ej. Ximelagatran)[10] |
Fibrinógeno | GVRGPR | Trombina | Anticoagulante |
Referencias
editar- ↑ Marshall GR, Ballante F (September 2017). «Limiting Assumptions in the Design of Peptidomimetics». Drug Development Research 78 (6): 245-267. PMID 28875546. doi:10.1002/ddr.21406.
- ↑ a b Pelay-Gimeno M, Glas A, Koch O, Grossmann TN (July 2015). «Structure-Based Design of Inhibitors of Protein-Protein Interactions: Mimicking Peptide Binding Epitopes». Angewandte Chemie 54 (31): 8896-927. PMC 4557054. PMID 26119925. doi:10.1002/anie.201412070.
- ↑ Brett D. Welch; Andrew P. VanDemark; Annie Heroux ; Christopher P. Hill (2007). «Potent D-peptide inhibitors of HIV-1 entry». Proceedings of the National Academy of Sciences (en inglés) 104 (43): 16828-16833. ISSN 0027-8424. PMID 17942675. doi:10.1073/pnas.0708109104. Parámetro desconocido
|issn2=ignorado (ayuda) - ↑ K. Gademann; T. Hintermann; J. V. Schreiber (1999). «Beta-peptides: twisting and turning». Current Medicinal Chemistry (en inglés) 6 (10): 905-925. ISSN 0929-8673. PMID 10519905.
- ↑ Walensky LD, Kung AL, Escher I, Malia TJ, Barbuto S, Wright RD, Wagner G, Verdine GL, Korsmeyer SJ (September 2004). «Activation of apoptosis in vivo by a hydrocarbon-stapled BH3 helix». Science 305 (5689): 1466-70. Bibcode:2004Sci...305.1466W. PMC 1360987. PMID 15353804. doi:10.1126/science.1099191.
- ↑ Blackwell HE, Grubbs RH (1998). «Highly Efficient Synthesis of Covalently Cross-Linked Peptide Helices by Ring-Closing Metathesis». Angewandte Chemie International Edition 37 (23): 3281-3284. PMID 29711420. doi:10.1002/(SICI)1521-3773(19981217)37:23<3281::AID-ANIE3281>3.0.CO;2-V.
- ↑ Ferreira SH, Greene LH, Alabaster VA, Bakhle YS, Vane JR (January de 1970). «Activity of various fractions of bradykinin potentiating factor against angiotensin I converting enzyme». Nature 225 (5230): 379-80. PMID 4312128.
- ↑ Roberts NA, Martin JA, Kinchington D, et al. (April de 1990). «Rational design of peptide-based HIV proteinase inhibitors». Science 248 (4953): 358-61. PMID 2183354.
- ↑ Pogozheva ID, Przydzial MJ, Mosberg HI (2005). «Homology modeling of opioid receptor-ligand complexes using experimental constraints». AAPS J 7 (2): E434-48. PMC 2750980. PMID 16353922. doi:10.1208/aapsj070243.
- ↑ Kikelj D (2003). «Peptidomimetic thrombin inhibitors». Pathophysiol. Haemost. Thromb. 33 (5–6): 487-91. PMID 15692265. doi:10.1159/000083850.