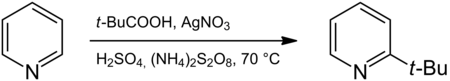Reacción de Minisci
La reacción de Minisci ( italiano: [miˈniʃʃi] ) es una reacción con nombre en química orgánica . Es una sustitución radical nucleófila de un compuesto aromático deficiente en electrones , más comúnmente la introducción de un grupo alquilo en un heterociclo que contiene nitrógeno . La reacción fue publicada en 1971 por F. Minisci. [1] En el caso de N-Heterociclos, las condiciones deben ser ácidas para asegurar la protonación de dicho heterociclo. [2] Una reacción típica es la que ocurre entre la piridina y el ácido piválico con nitrato de plata , ácido sulfúrico y persulfato de amonio para formar 2-terc-butilpiridina . La reacción se parece a la alquilación de Friedel-Crafts pero con reactividad y selectividad opuestas. [3]
La reacción de Minisci a menudo produce una mezcla de regioisómeros que pueden complicar la purificación del producto, pero las condiciones de reacción modernas son increíblemente suaves y permiten la introducción de una amplia gama de grupos alquilo. [4] Dependiendo de la fuente de radicales utilizada, una reacción secundaria es la acilación , [5] y la relación entre alquilación y acilación depende del sustrato y las condiciones de reacción. Debido a las materias primas económicas y las condiciones de reacción simples, la reacción de Minisci ha encontrado muchas aplicaciones en la química heterocíclica. [6][7]
Aplicaciones
editarLa reacción permite la alquilación de especies heterocíclicas deficientes en electrones, lo que no es posible con la química de Friedel-Crafts. Un método para alquilar arenos deficientes en electrones , la sustitución aromática nucleofílica , tampoco está disponible para los heterociclos deficientes en electrones, ya que las especies nucleofílicas iónicas utilizadas desprotonarán el heterociclo en lugar de actuar como un nucleófilo. Nuevamente, a diferencia de la sustitución aromática nucleofílica, la reacción de Minisci no requiere funcionalización del areno, lo que permite la funcionalización directa del CH. [8]
Además de esto, las especies de radicales alquilo generadas no se reorganizarán durante la reacción de la manera que a menudo lo hacen los fragmentos de alquilo añadidos mediante alquilación de Friedel-Crafts; es decir, grupos tales como grupos n-pentilo y ciclopropilo se pueden añadir sin cambios. El radical alquilo también es un nucleófilo "blando" y, por lo tanto, es muy poco probable que interactúe con electrófilos "duros" (especies carbonilo, por ejemplo) ya presentes en el heterociclo, lo que aumenta la tolerancia del grupo funcional de la reacción.[1] El radical alquilo también es un nucleófilo "blando" y, por lo tanto, es muy poco probable que interactúe con electrófilos "duros" (especies carbonilo, por ejemplo) ya presentes en el heterociclo, [9]
La reacción ha sido objeto de mucha investigación en los últimos años, centrándose en mejorar la reactividad hacia una mayor variedad de heterociclos, aumentar la cantidad de reactivos alquilantes que se pueden usar y emplear oxidantes y ácidos más suaves. [10][11]
Mecanismo
editarEn una descarboxilación oxidativa con sales de plata y un agente oxidante se forma un radical libre a partir del ácido carboxílico . El agente oxidante ( persulfato de amonio ) oxida el Ag (+) a Ag (2+) en condiciones de reacción ácida. Esto induce una abstracción del átomo de hidrógeno por parte de la plata, seguida de una descarboxilación radical . El radical centrado en carbono reacciona luego con el compuesto aromático de piridinio . El producto final se forma por rearomatización . El producto acilado se forma a partir del radical acilo.[4][5]
Referencias
editar- ↑ a b Minisci, F.; Bernardi, R.; Bertini, F.; Galli, R.; Perchinummo, M. (1971-01). «Nucleophilic character of alkyl radicals—VI». Tetrahedron (en inglés) 27 (15): 3575-3579. doi:10.1016/S0040-4020(01)97768-3. Consultado el 30 de septiembre de 2024.
- ↑ Li, Jie Jack (2009). «Minisci reaction». Name Reactions. pp. 361-362. ISBN 978-3-642-01052-1. doi:10.1007/978-3-642-01053-8_163.
- ↑ Strategic applications of named reactions in organic synthesis: background and detailed mechanisms László Kürti, Barbara Czakó 2005
- ↑ a b Fontana, Francesca; Minisci, Francesco; Nogueira Barbosa, Maria Claudia; Vismara, Elena (1991). «Homolytic acylation of protonated pyridines and pyrazines with .alpha.-keto acids: The problem of monoacylation». The Journal of Organic Chemistry 56 (8): 2866-2869. doi:10.1021/jo00008a050.
- ↑ a b Bennasar, M.-Lluïsa; Roca, Tomàs; Griera, Rosa; Bosch, Joan (2001). «Generation and Intermolecular Reactions of 2-Indolylacyl Radicals». Organic Letters 3 (11): 1697-1700. PMID 11405689. doi:10.1021/ol0100576.
- ↑ Miller, Benjamin; Palde, Prakash; McNaughton, Brian; Ross, Nathan; Gareiss, Peter; Mace, Charles; Spitale, Robert (2007). «Single-Step Synthesis of Functional Organic Receptors via a Tridirectional Minisci Reaction». Synthesis 2007 (15): 2287-2290. doi:10.1055/s-2007-983792.
- ↑ J. A. Joules, K. Mills: Heterocyclic Chemistry, 5. Auflage, S. 125–141, Blackwell Publishing, Chichester, 2010, ISBN 978-1-4051-9365-8.
- ↑ Antonietti, Fabrizio; Mele, Andrea; Minisci, Francesco; Punta, Carlo; Recupero, Francesco; Fontana, Francesca (February 2004). «Enthalpic and polar effects in the reactions of perfluoroalkyl radicals». Journal of Fluorine Chemistry 125 (2): 205-211. ISSN 0022-1139. doi:10.1016/j.jfluchem.2003.07.012.
- ↑ Tauber, Johannes; Imbri, Dennis; Opatz, Till; Tauber, Johannes; Imbri, Dennis; Opatz, Till (10 de octubre de 2014). «Radical Addition to Iminium Ions and Cationic Heterocycles». Molecules (en inglés) 19 (10): 16190-16222. PMC 6270771. PMID 25310148. doi:10.3390/molecules191016190.
- ↑ Duncton, Matthew A. J. (2011). «Minisci reactions: Versatile CH-functionalizations for medicinal chemists». MedChemComm (en inglés) 2 (12): 1135. ISSN 2040-2503. doi:10.1039/C1MD00134E.
- ↑ Proctor, R. S. J.; Phipps, R. J. (2019). «Recent Advances in Minisci‐Type Reactions». Angewandte Chemie International Edition 58 (39): 13666-13699. PMID 30888102. S2CID 83463455. doi:10.1002/anie.201900977.