Ácido pentético
El ácido pentético o ácido dietilentriaminopentaacético (DTPA) es un ácido aminopolicarboxílico formado por una dietilentriamina unida a cinco grupos carboximetilo. Podemos observar la molécula como una versión expandida de EDTA y se usa de manera similar. Se presenta como un sólido blanco hidrosoluble.[3]
| Ácido pentético | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Ácido 2-[Bis[2-[bis(carboximetil)amino]etil]amino]acético[1] | ||
| General | ||
| Otros nombres | DTPA | |
| Fórmula estructural |
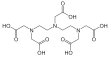 | |
| Fórmula molecular | C14H23N3O10 | |
| Identificadores | ||
| Número CAS | 67-43-6[2] | |
| Número RTECS | MB8205000 | |
| ChEBI | 35739 | |
| ChEMBL | CHEMBL780 | |
| ChemSpider | 2945 | |
| DrugBank | DB14007 | |
| PubChem | 3053 | |
| UNII | 7A314HQM0I | |
| KEGG | D05422 | |
|
C(CN(CC(=O)O)CC(=O)O)N(CCN(CC(=O)O)CC(=O)O)CC(=O)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido. Cristales blancos | |
| Masa molar | 393,138 g/mol | |
| Propiedades químicas | ||
| Acidez | 1.80 (20 °C) pKa | |
| Solubilidad en agua | <0,5g/100mL | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades de coordinación
editarLa base conjugada del DTPA tiene una alta afinidad por metales catiónicos. De esta manera el pentaanión DTPA5 es potencialmente un ligando octodentado si asumimos que cada centro de nitrógeno y cada grupo COO- cuentan como un centro de coordinación. Las constantes de formación para sus complejos son unas 100 veces mayores que los de la EDTA.[4]
Como agente quelante, el DTPA envolverá un ion metálico formando hasta ocho enlaces de coordinación; aunque los metales de transición generalmente formaran un número menor de enlaces de coordinación. De esta manera, tras formar un complejo con un metal, el DTPA todavía tendrá la capacidad de unirse a otros reactivos, como se muestra por su pentaderivado. Por ejemplo: en el complejo que forma con el cobre (II), el DTPA se unirá de forma hexadentada, utilizando tres centros de amina y tres de los cinco carboxilatos.[5]
Aplicaciones
editarDe la misma manera que el EDTA, el DTPA es utilizado principalmente para secuestrar iones metálicos que de otra manera descomponen el peróxido de hidrógeno, utilizado para blanquear la pasta necesaria para la fabricación de papel. Varios millones de kilos se producen anualmente con este propósito.
Sus propiedades quelantes son útiles en la desactivación de los iones de calcio y magnesio en productos para el cabello, siendo el DTPA utilizado en más de 150 productos cosméticos diferentes.[6] Además el DTPA se utiliza como agente de contraste para resonancia magnética - El DTPA mejorará la calidad de las imágenes de una resonancia magnética mediante la formación de un complejo con un ion de gadolinio. Este gadolinio tendrá propiedades paramagnéticas que alteraran el magnetismo de los protones del agua, aumentando la intensidad de la señal de lesiones que tengan la vascularidad alterada.[7]
El DTPA ha sido propuesto para el tratamiento de materiales radioactivos como el plutonio, americio y otros actínicos. Estos complejos, en teoría, son más propensos a ser eliminados en la orina. Normalmente se administrará en forma de sal de calcio o sal de zinc, ya que estos iones se desplazan fácilmente por cationes altamente cargados. De esta manera el DTPA formará complejos con el torio (IV), el uranio (IV), el neptunio (IV) y el cerio (III/IV).[8]
DTPA también se utiliza como un quelato de fertilizante de plantas para acuarios, específicamente hierro, un micronutriente esencial que normalmente se necesita en cantidades considerables para todas las plantas. Los quelatos son sustancias orgánicas disueltas que se unen a metales y les impiden formar moléculas más grandes a través de la oxidación. FeDTPTA es frecuentemente vendido bajo el nombre de quelato de hierro 10% o 11% cuando es utilizado en la fertilización de plantas de acuario.
El hierro típicamente encontrado en la columna de agua del acuario se ha convertido en su estado férrico (Fe 3+) al estar en la presencia de oxígeno disuelto, pero como las plantas requieren hierro en estado ferroso (Fe 2+), se debe aportar energía adicional para extraer el hierro de la columna de agua y convertirlo al estado ferroso. El DTPA se empleará para quelar ese hierro y mantenerlo en el estado ferroso, para que pueda ser utilizado por las plantas sin que gasten energía adicional.
También está indicada su utilización como antídoto ante intoxicaciones por metales pesados, dado su mecanismo de acción como quelante, formando complejos con estos metales (Hg, Cu, Pb, etc.); el quelato formado es de gran tamaño y esto impide que acceda desde la sangre a los tejidos y que por tanto el metal alcance su órgano diana.
Contraindicaciones
editarEl ácido pentético o DTPA se encuentra especialmente contraindicado en los casos de leucopenia, trombopenia e insuficiencia renal grave.
También hay que tener en cuenta que a veces los quelantes como el ácido pentético dan problemas de hipersensibilidad, dando alergias en algunas personas. Otro problema con los quelantes es que de alguna manera pueden deplecionar, formando quelatos con metales que tengan un interés biológico importante, siendo por ejemplo cofactores de alguna enzima. En este sentido podrán deplecionar esos metales de interés biológico y el efecto sería perjudicial para el individuo.
Relación de componentes
editar-Los compuestos que están estructuralmente relacionados con DTPA se utilizan en medicina, aprovechando la alta afinidad de la base de triaminopentacarboxilato para los iones metálicos.
-El ibritumomab tiuxetano es una versión modificada de DTPA cuya cadena principal de carbono contiene un bencil isotiocianato y un grupo metilo.[9]
-Los pentétidos capromab y satumomab son DTPA modificados que contienen un péptido enlazador utilizado para conectar el quelato con un anticuerpo.[10]
-La pentetreótida es un DTPA modificado unido a un segmento peptídico.[11]
-DTPA y sus derivados se utilizan para quelar el gadolinio para formar un agente de contraste en resonancia magnética, como el Magnevist.
-El tecnecio se quelará con DTPA para la gammagrafía pulmonar de ventilación y gammagrafía renal.
Referencias
editar- ↑ Anonymous Pentetic Acid. In Dictionary of Organic Compounds, Sixth Edition; Buckingham, J., Macdonald, F., Eds.; CRC Press: 1996; Vol. 5, pp 1188.
- ↑ Número CAS
- ↑ Moeller, T.; Thompson, L. C. Observations on the rare earths—LXXV(1): The stabilities of diethylenetriaminepentaacetic acid chelates. Journal of Inorganic and Nuclear Chemistry 1962, 24, 499.
- ↑ J. Roger Hart "Ethylenediaminetetraacetic Acid and Related Chelating Agents" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi 10.1002/14356007.a10_095
- ↑ V. V. Fomenko, T. N. Polynova, M. A. Porai-Koshits, G. L. Varlamova and N. I. Pechurova Crystal structure of copper (II) diethylenetriaminepentaacetate monohydrate Journal of Structural Chemistry, 1973, Vol. 14, 529. doi 10.1007/BF00747020
- ↑ Burnett, L. C. "Final Report on the Safety Assessment of Pentasodium Pentetate and Pentetic Acid as Used in Cosmetics" International Journal of Toxicology 2008, 27, 71-92.
- ↑ Caravan, Peter; Ellison, Jeffrey J.; McMurry, Thomas J. ; Lauffer, Randall B. "Gadolinium(III) Chelates as MRI Contrast Agents: Structure, Dynamics, and Applications" Chem. Revs. 1999, volume 99, pp. 2293–2342.
- ↑ (2) Brown, M. A.; Paulenova, A.; Gelis, A. V. "Aqueous Complexation of Thorium(IV), Uranium(IV), Neptunium(IV), Plutonium(III/IV), and Cerium(III/IV) with DTPA" Inorganic Chemistry 2012, volume 51, 7741-7748. doi 10.1021/ic300757k
- ↑ Milenic, Diane E.; Erik D. Brady; Martin W. Brechbiel (June 2004). «Antibody-targeted radiation cancer therapy». Nat Rev Drug Discov 3 (6): 488-99. ISSN 1474-1776. PMID 15173838. doi:10.1038/nrd1413.
- ↑ Kahn, Daniel; J. Christopher Austin; Robert T Maguire; Sara J Miller; Jack Gerstbrein; Richard D Williams (1999). «A Phase II Study of [90Y] Yttrium-Capromab Pendetide in the Treatment of Men with Prostate Cancer Recurrence Following Radical Prostatectomy». Cancer Biotherapy & Radiopharmaceuticals 14 (2): 99-111. doi:10.1089/cbr.1999.14.99.
- ↑ Liu, Shuang (15 de septiembre de 2008). «Bifunctional coupling agents for radiolabeling of biomolecules and target-specific delivery of metallic radionuclides». Advanced Drug Delivery Reviews 60 (12): 1347-70. ISSN 0169-409X. PMC 2539110. PMID 18538888. doi:10.1016/j.addr.2008.04.006.