Azocano
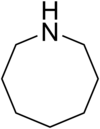
El azocano, también llamado heptametilenimina, azaciclooctano y perhidroazocina es un compuesto orgánico de fórmula molecular C7H15N. Su estructura química corresponde a una amina heterocíclica saturada de ocho miembros, con un único grupo amino secundario.
| Azocano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Azocano | ||
| General | ||
| Otros nombres |
Heptametilenimina Azaciclooctano Perhidroazocina Octahidroazocina | |
| Fórmula semidesarrollada | CH2(CH2)6NH | |
| Fórmula molecular | C7H15N | |
| Identificadores | ||
| Número CAS | 1121-92-2[1] | |
| Número RTECS | MI9804000 | |
| ChEBI | 38792 | |
| ChEMBL | CHEMBL3186488 | |
| ChemSpider | 13638 | |
| PubChem | 14276 | |
|
C1CCCNCCC1
| ||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro o ligeramente amarillo | |
| Densidad | 896 kg/m³; 0,896 g/cm³ | |
| Masa molar | 11 320 g/mol | |
| Punto de fusión | 18 °C (291 K) | |
| Punto de ebullición | 162 °C (435 K) | |
| Presión de vapor | 3,1 ± 0,2 mmHg | |
| Índice de refracción (nD) | 1,471 | |
| Propiedades químicas | ||
| Solubilidad en agua | 15 g/L | |
| log P | 2,06 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 302,15 K (29 °C) | |
| Compuestos relacionados | ||
| heterociclos con un grupo amino |
Pirrolidina Piperidina Azepano Azecano | |
| heterociclos con dos grupos amino |
Piperazina 1,4-diazepano | |
| heterociclos con nitrógeno y azufre | Tiomorfolina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Características físicas y químicas
editarA temperatura ambiente, el azocano es un líquido incoloro o ligeramente amarillo.[2] Tiene su punto de ebullición a 162 °C[3] —a una presión muy inferior a la atmosférica (15 mmHg) su punto de ebullición es de 52 °C— mientras que su punto de fusión es 18 °C. En estado sólido, cristaliza en el sistema cúbico.[4]
En fase líquida, tiene una densidad inferior a la del agua (ρ = 0,896 g/cm³),[5] siendo muy poco soluble en ella (15 g/L). El valor del logaritmo de su coeficiente de reparto, logP = 2,06, pone de manifiesto una solubilidad unas cien veces mayor en disolventes apolares —como el 1-octanol— que en disolventes polares.[6][7]
Síntesis y usos
editarEl azocano se puede sintetizar a partir de la 2-azacyclooctanona. Esta síntesis puede llevarse a cabo por hidrogenolisis selectiva de los enlaces C-N utilizando un catalizador de platino —con una proporción de este metal del 40%— sobre sílice;[8] o bien usando un catalizador bimetálico consistente en un metal de transición de los grupos 8-10 junto a otro metal de transición de los grupos 6-7.[9] Otra vía de síntesis diferente tiene como precursor el 1,7-dibromoheptano.[10]
Se ha investigado la posible relación entre el azocano y la formación de tumores cancerígenos en hígado y pulmones; la formación de nitrosaminas —formadas en el tracto intestinal por nitritos de los alimentos junto a aminas secundarias como el azocano, ingeridas de forma deliberada o accidental— puede ser la causa de aparición de los citados tumores.[11]
En cuanto a sus aplicaciones, el azocano puede ser utilizado como repelente para artrópodos, ya que enmascara los olores que atraen a los insectos. Se ha planteado su uso como sustituto del DEET, ingrediente habitual de los repelentes de insectos, pudiendo ser aplicado sobre la piel.[12]
Precauciones
editarEl azocano es un compuesto combustible cuyo punto de inflamabilidad es 29 °C. Es una sustancia corrosiva e irritante, pudiendo ocasionar irritación en ojos, piel, mucosas y vías respiratorias.[13]
Véase también
editarLos siguientes compuestos son isómeros del azocano:
Referencias
editar- ↑ Número CAS
- ↑ Heptamethyleneimine (PubChem)
- ↑ «Heptamethyleneimine (TCI America)». Archivado desde el original el 17 de septiembre de 2016. Consultado el 23 de junio de 2016.
- ↑ Bond AD, Davies JE, Parsons S. (2008). «Azetidine, pyrrolidine and hexamethyleneimine at 170 K». Acta Crystallog. C 64 (Pt 10): 543-546. Consultado el 23 de junio de 2016.
- ↑ Heptamethyleneimine (Sigma-Aldrich)
- ↑ Azocane (ChemSpider)
- ↑ Azocane(111-49-9) (Chemical Book)
- ↑ Mary J. Guttieri, Wilhelm F. Maier (1984). «Selective cleavage of carbon-nitrogen bonds with platinum». J. Org. Chemistry 49 (16): 2875-2880. Consultado el 23 de junio de 2016.
- ↑ Chitaru Hirosawa, Noriko Wakasa, Takamasa Fuchikami (1998). «Hydrogenation of amides by the use of bimetallic catalysts consisting of group 8 to 10, and group 6 or 7 metals». Tetrahedron Letters 37 (37): 6749-6752. Consultado el 20 de junio de 2016.
- ↑ Azocane (Molbase)
- ↑ W. Lijinsky, H.W. Taylor, C. Snyder, P. Nettesheim (1973). «Malignant Tumours of Liver and Lung in Rats fed Aminopyrine or Heptamethyleneimine together with Nitrite». Nature 244: 176-178. Consultado el 23 de junio de 2016.
- ↑ Methods and compositions for repelling arthropods (2008). Ulrich R. Bernier, Kenneth H. Posey, Daniel L. Kline, Donald R. Barnard, Kamal Chauhan. Patente WO 2008083038 A1.
- ↑ Heptamethyleneimine. Safety sheet. (Pfaltz and Bauer) Archivado el 12 de agosto de 2016 en Wayback Machine.