Óxido de titanio(IV)
El óxido de titanio o dióxido de titanio es un compuesto químico cuya fórmula es TiO2. El titanio es el noveno elemento más común en la Tierra y en condiciones normales es muy común que reaccione con oxígeno para formar óxidos de titanio, estos se encuentran en minerales y polvos. Es barato y abundante por lo que es usado en prácticamente todas las industrias.
| Óxido de titanio | ||
|---|---|---|
 Dióxido de titanio. | ||
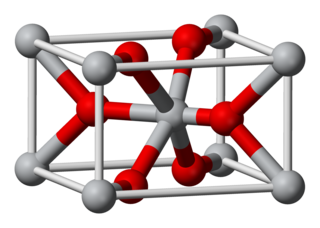 Estructura tridimensional. | ||
| Nombre IUPAC | ||
| Óxido de titanio(IV) | ||
| General | ||
| Fórmula molecular | TiO2 | |
| Identificadores | ||
| Número CAS | 13463-67-7, 1309-63-3[1] | |
| Número RTECS | XR2775000 | |
| ChEBI | 32234 | |
| ChEMBL | CHEMBL1201136 | |
| ChemSpider | 24256 | |
| DrugBank | DB09536 | |
| PubChem | 26042 | |
| KEGG | D01931 C13409, D01931 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 4200 kg/m³; 4,2 g/cm³ | |
| Punto de fusión | 2103 K (1830 °C) | |
| Punto de ebullición | 2773 K (2500 °C) | |
| Estructura cristalina | Rutilo | |
| Propiedades químicas | ||
| Solubilidad en agua | Insoluble | |
| Riesgos | ||
| Ingestión | Bajo riesgo si la ingestión es accidental. | |
| Inhalación | Irritante, peligroso a largo plazo. | |
| Piel | Bajo riesgo. Cuestionado. | |
| Ojos | Bajo riesgo. Cuestionado. | |
| Más información | Hazardous Chemical Database (En inglés) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
En la naturaleza existe en varias formas: brookita (estructura ortorrómbica), anatasa (estructura tetragonal) y rutilo (estructura tetragonal). Tanto el rutilo como la anatasa son producidos a gran escala de forma industrial y se los usa principalmente como catalizadores o pigmentos para superficies. Su producción anual fue de 8 400 000 toneladas en el año 2019[2].
El dióxido de titanio también es usado como colorante para comidas con la numeración E171.
Estructura
editarEn sus tres dióxidos principales, el titanio presenta una geometría octaédrica, estando unido a seis aniones óxido. Los óxidos, a su vez, están unidos a tres centros de Ti. Las estructuras cristalinas generales del rutilo y la anatasa son de simetría tetragonal, mientras que la brookita es ortorrómbica. Todas las subestructuras de oxígeno son ligeras distorsiones del empaquetamiento compacto: en el rutilo, los aniones de óxido están dispuestos en un empaquetamiento estrecho hexagonal distorsionado, mientras que en la anatasa están próximos al empaquetamiento estrecho cúbico y en la brookita al "empaquetamiento estrecho hexagonal doble". La estructura de rutilo está muy extendida en otros dióxidos y difluoruros metálicos, como RuO2 y ZnF2.
El dióxido de titanio fundido tiene una estructura local en la que cada Ti está coordinado, por término medio, con unos 5 átomos de oxígeno.[3] Esto es distinto de las formas cristalinas en las que el Ti se coordina con 6 átomos de oxígeno.
.
Química
editarEl dióxido de titanio es anfótero,[4] químicamente muy estable, no es atacado por compuestos orgánicos o inorgánicos (no es atacado por ácidos o álcalis) y se disuelve en ácido sulfúrico concentrado y ácido fluorhídrico.[5] Además se descubrió que es un excelente fotocatalizador, lo que quiere decir que acelera las reacciones provocadas por la luz.
Propiedades físicas
editarRefleja la mayoría de la radiación electromagnética visible, por lo que es un muy buen pigmento blanco. Además absorbe la luz ultravioleta y es capaz de mantener su color a pesar de estar en exposición a la radiación solar.
Aplicaciones
editarTiene una amplia gama de aplicaciones en la industria química en general.[6] Los pigmentos de dióxido de titanio se utilizan principalmente en la producción de pinturas y plásticos, así como en papel, tintas de impresión, cosméticos, productos textiles, farmacéuticos y alimentarios. El dióxido de titanio es el pigmento más habitualmente utilizado en el mundo, que proporciona a los productos finales una brillante blancura, opacidad y protección.[7] Así mismo, es empleado en las artes gráficas donde se precisan pequeños espesores de pigmentos, como de dióxido de titanio, muy finos. También se ha usado como agente blanqueador y opacador en esmaltes de porcelana, dando un acabado final de gran brillo, dureza y resistencia al ácido.
Investigadores de la Universidad tecnológica de Nanyang en Singapur informaron en octubre de 2014 que utilizando un gel de una mezcla de dióxido de titanio e hidróxido de sodio en el ánodo de una batería esta puede recargarse hasta un 70 % de su capacidad en solo 2 minutos y tener una vida útil de más de 20 años (10 000 ciclos de recarga), diez veces más que una batería de Li-ion existente (500 ciclos de recarga), dando así origen a baterías de carga ultrarrápida. Estos investigadores han hallado una manera de transformar la forma esférica del dióxido de titanio en diminutos nanotubos, que son mil veces más delgados que el diámetro de un cabello humano. Este nuevo gel se podrá integrar muy fácilmente a los actuales procesos de producción de los fabricantes de baterías con lo que su incorporación a la industria se verá muy favorecida.[8]
Plásticos: sus propiedades permiten minimizar la fragilidad, la decoloración y otros efectos adversos que genera la luz. Por lo que el dióxido permite extender la vida útil de una gran variedad de plásticos y cauchos.
Papel: se lo aplica cuando se requiere tener un papel más blanco, más opaco y brillante.
Cosméticos: permite ocultar imperfecciones de la piel y darle brillo para que luzca mejor.
Pinturas: la opacidad y su alto nivel de estabilidad permite una larga duración de la pintura o cualquier revestimiento. Reemplaza a cualquier otro pigmento blanco en el mercado por su capacidad de mantener el color.
Industria de alimentos y farmacéutica: usado ampliamente en esta industria porque al ser un material opaco que absorbe la radiación protege a productos que la luz pueda degradar como jarabes y otros medicamentos. Además alarga la vida de los alimentos porque los aísla y no permite el paso de la luz.
A nanoescala
editarCatalizadores: En la industria se usa como material de apoyo para catalizadores, sus aplicaciones en vehículos incluyen eliminación de gases de escape que son dañinos.
Protectores Solares: el pigmento de dióxido de titanio tiende a reflejar la luz, sin embargo el TiO2 ultra fino tiene la capacidad de volverse transparente a la luz visible pero absorbe la luz ultravioleta, protegiendo así a la piel de los rayos UV que generan problemas a la piel.[9]
Otras aplicaciones:Industria cerámica, la manufactura de cemento blanco, el coloreado de hule y agente para el tratamiento de agua.
Producción y presencia
editarLa producción de TiO2 llega a alcanzar ventas de 4 millones de toneladas anuales, es el pigmento blanco más producido en el mundo, y su consumo sigue un aumento de alrededor de 2 % anual (2004). Los grandes consumidores de este compuesto son las industrias de pinturas y plásticos. La elaboración del dióxido de titanio genera 3.8 toneladas de productos derivados por cada tonelada de TiO2 producida. Generalmente estos productos son vendidos o reciclados, convertidos en productos que servirán como materia prima para otras industrias: elaboración de cementos, agricultura o tratamiento de terrenos.
El TiO2 sintético se produce principalmente a partir del mineral ilmenita. El rutilo y la anatasa, que se dan de forma natural, también están muy extendidos, por ejemplo, el rutilo como "mineral pesado" en la arena de playa. El leucoxeno, anatasa de grano fino formada por alteración natural de la ilmenita, es otro mineral. El zafiro estrellas y el rubíes obtienen su asterismo de inclusiones orientadas de agujas de rutilo.[10]
Mineralogía y polimorfos poco comunes
editarEl dióxido de titanio se presenta en la naturaleza como los minerales rutilo y anatasa. Además se conocen dos formas minerales de alta presión: un monoclínico baddeleyita conocida como akaogiita, y la otra tiene una ligera distorsión monoclínica del ortorrómbico. α-PbO2 y se conoce como riesita. Ambas pueden encontrarse en el Cráter de Ries en Baviera.[11][12][13] Se obtiene principalmente de la ilmenita, que es el mineral con dióxido de titanio más extendido en todo el mundo. El rutilo es el siguiente más abundante y contiene alrededor del 98 % de dióxido de titanio en el mineral. Las fases metaestables anatasa y brookita se convierten irreversiblemente en la fase de equilibrio rutilo al calentarse por encima de temperaturas en el rango 600-800 grados Celsius (1110-1470 °F).[14]
Se afirmó que la fase de tipo cotunnita era el óxido más duro conocido, con una dureza Vickers de 38 GPa y un módulo de masa de 431 GPa (es decir, cercano al valor del diamante de 446 GPa) a presión atmosférica.[15] Sin embargo, estudios posteriores llegaron a conclusiones diferentes con valores mucho más bajos tanto para la dureza (7-20 GPa, lo que lo hace más blando que los óxidos comunes como el corindón Al2O3 y el rutilo TiO2)[16] y módulo aparente (~300 GPa).[17][18]
El dióxido de titanio (B) se encuentra como mineral en rocas magmáticas y venas hidrotermales, así como en bordes de meteorización sobre perovskita. El TiO2 también forma lamelas en otros minerales.[19]
El dióxido de titanio tiene doce polimorfos conocidos: además de rutilo, anatasa, brookita, akaogiita y riesita, se pueden producir sintéticamente tres fases metaestables (monoclínico, tetragonal, y ortorrómbica tipo ramsdellita), y también existen cuatro formas de alta presión (tipo α-PbO2, tipo cotunnita, OI ortorrómbica y fases cúbicas):
Investigación
editarFotocatalizador
editarEl dióxido de titanio nanométrico, especialmente en su forma anatasa, presenta actividad fotocatalítica bajo irradiación ultravioleta (UV). Según se informa, esta fotoactividad es más pronunciada en los planos {001} de la anatasa,[20][21] aunque los planos {101} son termodinámicamente más estables y por lo tanto más prominentes en la mayoría de las anatasas sintetizadas y naturales,[22] como evidencia el hábito de crecimiento dipiramidal tetragonal que se observa con frecuencia. Se considera además que las interfaces entre el rutilo y la anatasa mejoran la actividad fotocatalítica al facilitar la separación de portadores de carga y, como resultado, a menudo se considera que el dióxido de titanio bifásico posee una funcionalidad mejorada como fotocatalizador.[23] Se ha informado de que el dióxido de titanio, cuando está dopado con iones de nitrógeno o dopado con óxido metálico como el trióxido de tungsteno, exhibe excitación también bajo luz visible.[24] El fuerte oxidativo de los huecos positivos oxida el agua para crear radicales hidroxilos. También puede oxidar oxígeno o materiales orgánicos directamente. Por lo tanto, además de su uso como pigmento, el dióxido de titanio puede añadirse a pinturas, cementos, ventanas, azulejos u otros productos por sus propiedades esterilizantes, desodorizantes y antiincrustantes, y se utiliza como catalizador de hidrólisis. También se utiliza en células solares sensibilizadas por colorante, que son un tipo de célula solar química, también conocida como célula de Graetzel.
Las propiedades fotocatalíticas del dióxido de titanio nanométrico fueron descubiertas por Akira Fujishima en 1967[25] y publicadas en 1972.[26] El proceso en la superficie del dióxido de titanio se denominó efecto Honda-Fujishima' (ja:本多-藤嶋効果).[25] El dióxido de titanio, en forma de película fina y nanopartícula tiene potencial para su uso en la producción de energía: como fotocatalizador, puede descomponer el agua en hidrógeno y oxígeno. Con el hidrógeno recogido, podría utilizarse como combustible. La eficacia de este proceso puede mejorarse enormemente dopando el óxido con carbono.[27] Se ha obtenido una mayor eficiencia y durabilidad introduciendo desorden en la estructura reticular de la capa superficial de nanocristales de dióxido de titanio, lo que permite la absorción de infrarrojos.[28] Se ha desarrollado anatasa y rutilo nanoactivos a la luz visible para aplicaciones fotocatalíticas.[29][30]
En 1995 Fujishima y su grupo descubrieron el fenómeno de superhidrofilia en vidrios recubiertos de dióxido de titanio expuestos a la luz solar.[25] Esto dio lugar al desarrollo de vidrios autolimpiables y antivaho.
TiO2 nanoscópico incorporado a materiales de construcción para exteriores, como adoquines en noxer blocks[31] o pinturas, podrían reducir las concentraciones de contaminantes atmosféricos como compuestos orgánicos volátiles y óxido de nitrógeno.[32] Se ha producido un cemento que contiene TiO2.[33].
Utilizando TiO2 como fotocatalizador, se ha intentado mineralizar contaminantes (para convertirlos en CO2 y H2O) en aguas residuales.[34][35][36] La destrucción fotocatalítica de la materia orgánica también podría aprovecharse en recubrimientos con aplicaciones antimicrobianas.[37]
Seguridad
editarComo este compuesto es usado en la industria alimenticia y farmacéutica la FDA debe examinar si es un compuesto seguro, que no afecte la salud pública. La FDA evaluó la seguridad del TiO2 y publicó una guía en la que establece que se puede utilizar con seguridad y lo clasificó como compatible con las mucosas y la piel. Sin embargo, la IARC (Agencia Internacional para la Investigación del Cáncer) lo clasificó como un compuesto “posiblemente cancerígeno para los seres humanos”. Su investigación se basó en estudios realizados en ratas, el estudio reveló que las ratas al inhalar el compuesto aumentaron la probabilidad de generar tumores pulmonares. Además, se realizaron estudios en trabajadores de la industria del TiO2, pero no se encontró una relación clara entre la exposición y el aumento de células cancerígenas, pero se estableció un límite de exposición permisible para proteger la salud de estos trabajadores.
Referencias
editar- ↑ 1309-63-3 Número CAS
- ↑ «Titanium Statistics and Information | U.S. Geological Survey». www.usgs.gov (en inglés). Consultado el 17 de mayo de 2022.
- ↑ Alderman, O. L. G., Skinner, L. B., Benmore, C. J., Tamalonis, A., Weber, J. K. R. (2014). «Estructura del dióxido de titanio fundido». Physical Review B 90 (9): 094204. Bibcode:2014PhRvB..90i4204A. doi:10.1103/PhysRevB.90.094204.
- ↑ «Óxido de titanio(IV)». Consultado el 26 de mayo de 2017.
- ↑ «Propiedades del óxido de titanio(IV) El tamiz Pedro Gómez Esteban». Consultado el 26 de mayo de 2017.
- ↑ Aplicaciones del dióxido de titanio
- ↑ Martínez Hernández, Juan (2010). La Urraca y el Pez. Reflexiones sobre Salud y Sociedad (Primera edición). Sevilla: Editorial Círculo Rojo. ISBN 978-84-15143-19-2.
- ↑ «NTU develops ultra-fast charging batteries that last 20 years» (en inglés). 13 de octubre de 2014. Archivado desde el original el 18 de octubre de 2018. Consultado el 16 de octubre de 2014.
- ↑ «Sunscreens: Safe and Effective?». Consultado el 26 de mayo de 2017.
- ↑ Emsley, John (2001). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press. pp. 451-53. ISBN 978-0-19-850341-5.
- ↑ El, Goresy; Chen, M; Dubrovinsky, L; Gillet, P; Graup, G (2001). «Un polimorfo ultradenso de rutilo con titanio de siete coordenadas procedente del cráter de Ries.». Science 293 (5534): 1467-70. Bibcode:2001Sci...293.1467E. PMID 11520981. S2CID 24349901. doi:10.1126/science.1062342.
- ↑ El Goresy, Ahmed; Chen, Ming; Gillet, Philippe; Dubrovinsky, Leonid; Graup, GüNther; Ahuja, Rajeev (2001). «Un polimorfo denso de rutilo inducido por choque natural con estructura α-PbO2 en la suevita del cráter de Ries en Alemania». Earth and Planetary Science Letters 192 (4): 485. Bibcode:192 ..485E 2001E&PSL. 192 ..485E.
- ↑ Akaogiite. mindat.org
- ↑ Hanaor, Dorian A. H.; Sorrell, Charles C. (February 2011). «Revisión de la transformación de fase anatasa a rutilo». Journal of Materials Science 46 (4): 855-874. Bibcode:2011JMatS..46..855H. S2CID 97190202.
- ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasdu1 - ↑ Oganov A.R.; Lyakhov A.O. (2010). «Hacia la teoría de la dureza de los materiales». Journal of Superhard Materials 32 (3): 143-147. Bibcode:2010arXiv1009.5477O. S2CID 119280867. arXiv:1009.5477. doi:10.3103/S1063457610030019.
- ↑ Al-Khatatbeh, Y.; Lee, K. K. M.; Kiefer, B. (2009). «Comportamiento a alta presión del TiO2 determinado mediante experimentos y teoría». Phys. Rev. B 79 (13): 134114. Bibcode:2009PhRvB..79m4114A.
- ↑ Nishio-Hamane D.; Shimizu A.; Nakahira R.; Niwa K.; Sano-Furukawa A.; Okada T.; Yagi T.; Kikegawa T. (2010). «La estabilidad y ecuación de estado de la fase cotunnita del TiO2 hasta 70 GPa». Phys. Chem. Minerals 37 (3): 129-136. Bibcode:2010PCM....37..129N. S2CID 95463163. doi:10.1007/s00269-009-0316-0.
- ↑ Banfield, J. F., Veblen, D. R., y Smith, D. J. (1991). «La identificación de TiO2 (B) de origen natural mediante la determinación de la estructura utilizando microscopía electrónica de alta resolución, simulación de imágenes y refinamiento por mínimos cuadrados de distancia». American Mineralogist 76: 343.
- ↑ Liang Chu (2015). «Nanopartículas de TiO2 anatasa con facetas {001} expuestas para células solares sensibilizadas con colorantes eficientes». Scientific Reports 5: 12143. Bibcode:..512143C 2015NatSR. ..512143C. PMC 4507182. PMID 26190140.
- ↑ Li Jianming and Dongsheng Xu (2010). «tetragonal faceted-nanorods of anatase TiO2 single crystals with a large percentage of active {100} facets». Chemical Communications 46 (13): 2301-3. PMID 20234939.
- ↑ M Hussein N Assadi (2016). researchgate.net/publication/304714130 «Los efectos del dopaje de cobre en la actividad fotocatalítica en (101) planos de TiO 2 anatasa: Un estudio teórico». Applied Surface Science 387: 682-689. Bibcode:2016ApSS..387..682A. S2CID 99834042. arXiv:1811.09157.
- ↑ Hanaor, Dorian A. H.; Sorrell, Charles C. (2014). «Fotocatalizadores de TiO2 de fase mixta soportados en arena para aplicaciones de descontaminación de agua». Advanced Engineering Materials 16 (2): 248-254. Bibcode:2014arXiv1404.2652H. S2CID 118571942. arXiv:1404.2652.
- ↑ Kurtoglu M. E.; Longenbach T.; Gogotsi Y. (2011). «Prevención del envenenamiento por sodio de películas fotocatalíticas de TiO2 sobre vidrio mediante dopaje metálico». International Journal of Applied Glass Science 2 (2): 108-116.
- ↑ a b c "Descubrimiento y aplicaciones de la fotocatálisis - Creación de un futuro confortable aprovechando la energía de la luz". Japan Nanonet Bulletin Número 44, 12 de mayo de 2005.
- ↑ Fujishima, Akira; Honda, Kenichi (1972). «Fotólisis electroquímica del agua en un electrodo semiconductor». Nature 238 (5358): 37-8. Bibcode:...37F 1972Natur.238 ...37F. PMID 12635268. S2CID 4251015. doi:10.1038/238037a0.
- ↑ «El dióxido de titanio dopado con carbono es un fotocatalizador eficaz». Advanced Ceramics Report. 1 de diciembre de 2003. Archivado desde el original el 4 de febrero de 2007. Consultado el 18 de agosto de 2023. «Este dióxido de titanio dopado con carbono es muy eficaz; bajo luz visible artificial, descompone el clorofenol cinco veces más eficazmente que la versión dopada con nitrógeno.»
- ↑ ¿Maneras baratas y limpias de producir hidrógeno para su uso en pilas de combustible? A Dash of Disorder Yields a Very Efficient Photocatalyst. Sciencedaily (28 de enero de 2011)
- ↑ Karvinen, Saila (2003). «Preparación y caracterización de anatasa mesoporosa activa a la luz visible». Solid State Sciences. 5 2003 (8): 1159-1166. Bibcode:2003SSSci...5.1159K. doi:10.1016/S1293-2558(03)00147-X.
- ↑ Bian, Liang; Song, Mianxin; Zhou, Tianliang; Zhao, Xiaoyong; Dai, Qingqing (Junio 2009). elsevier.com/retrieve/pii/S1002072108602707 «Cálculo del hueco de banda y actividad fotocatalítica del TiO2 rutilo dopado con tierras raras». Journal of Rare Earths 27 (3): 461-468.
- ↑ Advanced Concrete Pavement materials Archivado el 20 de junio de 2013 en Wayback Machine., National Concrete Pavement Technology Center, Iowa State University, p. 435.
- ↑ Hogan, Jenny (4 de febrero de 2004) "Smog-busting paint soaks up noxious gases". New Scientist.
- ↑ TIME's Best Inventions of 2008. (31 de octubre de 2008).
- ↑ Winkler, Jochen (2003). Dióxido de titanio. Hannover: Vincentz Network. pp. 115-116. ISBN 978-3-87870-148-4.
- ↑ Konstantinou, Ioannis K; Albanis, Triantafyllos A (2004). «Degradación fotocatalítica asistida por TiO2 de colorantes azoicos en solución acuosa: Investigaciones cinéticas y mecanísticas». Applied Catalysis B: Environmental 49: 1-14.
- ↑ Hanaor, Dorian A. H.; Sorrell, Charles C. (2014). «Fotocatalizadores de TiO2 de fase mixta soportados en arena para aplicaciones de descontaminación de agua». Advanced Engineering Materials 16 (2): 248-254. S2CID 118571942. arXiv:1404.2652.
- ↑ Ramsden, Jeremy J. (2015). «Revestimientos antimicrobianos fotocatalíticos». Nanotechnology Perceptions 11 (3): 146-168.
Enlaces externos
editar- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del óxido de titanio(IV).
- http://news.bbc.co.uk/1/hi/health/2162248.stm
- ¿Para qué se usa el dióxido de titanio?. Quiminet
- ¿Qué tiene que ver conmigo el TiO2?. El Tamiz