Cambio de estado
En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición.[1] Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en el universo es el plasma, material del que están compuestas las estrellas (si se descarta la materia oscura).
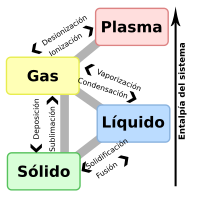

Los tipos de cambio de estado de la materia
editarSon los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:[1]
- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
Esto ocurre porque en la fase sólida las moléculas se mantienen unidas formando una estructura cristalina rígida, de tal manera que la sustancia tiene una forma y volumen definidos.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización: Es el procesos físicos en el que un líquido pasa a un gas. Se puede alcanzar por evaporación o por ebullición. En la evaporación, la vaporización sucede a cualquier temperatura y solo en la superficie del líquido, mientras que en la ebullición, la vaporización ocurre en todo el volumen del líquido a la llamada temperatura de ebullición. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión al continuar calentando el líquido, este absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
- Deposición o sublimación inversa: Es el paso directo del estado gaseoso al estado sólido.
- Ionización: Es el cambio de un gas a plasma.
- Desionización: Es el cambio de un plasma a gas.
Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.
Los cambios de estado están divididos generalmente en dos tipos: progresivos y regresivos.
- Cambios progresivos: Vaporización, fusión y sublimación progresiva.
- Cambios regresivos: Condensación, solidificación y sublimación regresiva
La siguiente tabla indica cómo se denominan los cambios de estado:
| Inicial\Final | Sólido | Líquido | Gas | Plasma |
|---|---|---|---|---|
| Sólido | fusión | sublimación, sublimación progresiva o sublimación directa | ||
| Líquido | solidificación | evaporación o ebullición | ||
| Gas | sublimación inversa, regresiva o deposición | condensación y licuefacción (licuación) | Ionización | |
| Plasma | Desionización |
También se puede ver claramente con el siguiente gráfico:
Punto de fusión
editarEl punto de fusión es la temperatura a la cual la materia pasa de estado sólido a estado líquido, es decir, se funde.[1]
Al efecto de fundir un metal se le llama fusión (no podemos confundirlo con el punto de fusión). También se suele denominar fusión al efecto de licuar o derretir una sustancia sólida, congelada o pastosa, en líquida.
En la mayoría de las sustancias, el punto de fusión y de congelación, son iguales. Pero esto no siempre es así: por ejemplo, el agar-agar se funde a 85 °C y se solidifica a partir de los 31 °C a 40 °C; este proceso se conoce como histéresis.
En geología, se denomina punto de solidus a la temperatura en la que empieza a fundirse una roca y punto de liquidus a la temperatura en la que la fusión es total. Tanto la presencia de agua como una disminución de la presión pueden rebajar los puntos de solidus y liquidus de una roca, facilitando la formación de magmas sin aumentar la temperatura.[2]
Punto de ebullición
editarEl punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso.[1] Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido. En esas condiciones se puede formar vapor en cualquier punto del líquido.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, solo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que lo componen).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente - dipolo inducido o puentes de hidrógeno).
Véase también
editarReferencias
editar- ↑ a b c d Rosales, Elizabeth (2005-03). Química 1 para bachillerato/ Chemistry 1 for High School. DO NOT USE. ISBN 9789681866327. Consultado el 10 de marzo de 2018.
- ↑ Anguita, F. y Moreno, F. (1991). «Magmas». Procesos geológicos internos. Editorial Rueda. pp. 73-101. ISBN 84-7207-063-8.
- Physical Science Study Committee (aggregation states 1965) ISBN 9780669974515