Conductividad (electrolítica)
La conductividad (o conductancia específica) de una solución de electrolito es una medida de su capacidad para conducir la electricidad. La unidad de medida en el Sistema Internacional, SI, es el siemens por metro (S/m). Las medidas de conductividad se utilizan de forma rutinaria en muchas aplicaciones industriales y medioambientales como un modo rápido, barato y fiable de medir el contenido iónico en una solución.[1] Por ejemplo, la medida de la conductividad del producto es un modo típico de supervisar instantánea y continuamente la tendencia del funcionamiento de los sistemas de purificación del agua.
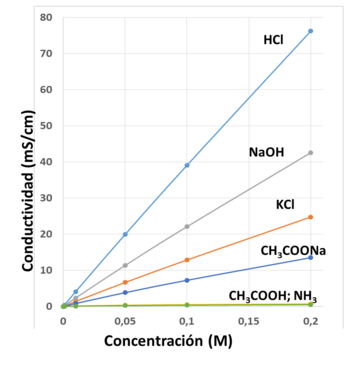
En muchos casos, la conductividad está directamente vinculada a la cantidad de sólidos totales disueltos (TDS). El agua desionizada de alta calidad tiene una conductividad de 5,5 μS/m, el agua potable típica en el rango de 5-50 mS/m, mientras que el agua de mar cerca de 5 S/m.[2] (es decir, la conductividad del agua de mar es un millón de veces mayor que el agua desionizada).
La conductividad se determina habitualmente midiendo la resistencia AC de una solución entre dos electrodos. Las soluciones diluidas siguen las leyes de Kohlrausch de la dependencia de la concentración y la aditividad de las concentraciones iónicas. Onsager dio una explicación teórica de la ley de Kohlrausch por extensión de la ecuación de Debye–Hückel.
Unidades
editarLa unidad de medida en el Sistema Internacional es el S/m y suele referirse a la temperatura de 25 °C (temperatura estándar). Para cualquier otro temperatura, debe especificarse, pues la conductividad de las disoluciones esta fuertemente afectada por la temperatura. A menudo, en la industria se utiliza la tradicional unidad de μS/cm. Los valores de μS/cm son más altos que los de μS/m en un factor de 100. De vez en cuando se encuentra en la escala de los instrumentos una unidad denominada como "CE" (conductividad eléctrica): 1 CE = 1 S/cm. A veces, en la literatura científica y técnica se encuentra expresada en ohm-1.cm-1 , ya que 1 S equivale a un ohmio inverso por lo que también, más raramente, la conductividad de las disoluciones, puede aparecer como 1 mho/m = 1 S/m donde mho es el recíproco de ohmio.
La célula estándar comúnmente utilizada tiene un ancho de 1 cm, y así, para agua muy pura en equilibrio con el aire podría tener una resistencia de aproximadamente 106 ohm, conocido como Megaohmio. El agua ultra pura podría alcanzar 10 megaohms o más. Así, en el pasado, se utilizó el Megaohmio-cm (= μS/cm), a veces abreviado a "Megaohmio", MΩ. A veces, una conductividad se da sólo en "microSiemens" (omitiendo el término de distancia en la unidad). Si bien esto es un error, a menudo se puede suponer que es igual a la tradicional μS/cm. La típica conversión de la conductividad a los sólidos disueltos totales se realiza suponiendo que el sólido es cloruro de sodio: 1 μS/cm es equivalente entonces a cerca de 0,6 mg de NaCl por kg de agua.
La conductividad molar tiene en el SI la unidad S.m2.mol−1. Las publicaciones más antiguas utilizan la unidad Ω−1.cm2.mol−1.
Medida
editarLa conductividad eléctrica de un electrolito en disolución dese establece determinando la resistencia de la solución entre dos electrodos planos o cilíndricos separados por una distancia fija.[3] Se utiliza una tensión alterna para evitar la electrólisis. Las frecuencias más utilizadas están en el rango 1-3 kHz. La dependencia de la frecuencia suele ser pequeña.[4] La resistencia se mide con un conductímetro.
Está disponible comercialmente una gran variedad de instrumentos.[5] Hay dos tipos de celdas, el tipo clásico con electrodos planos o cilíndricos y un segundo tipo basado en la inducción.[6] Muchos sistemas comerciales ofrecen corrección automática de temperatura.
Definiciones
editarLa resistencia R es proporcional a la distancia l entre los electrodos e inversamente proporcional al área transversal de la muestra A. Escribiendo ρ (rho) para la resistencia específica (o resistividad),
En la práctica la sonda de conductividad se calibra utilizando disoluciones de resistencia específica conocida, ρ*, por lo que los valores de l y A son datos de diseño de la sonda.[7] Si la resistencia de la solución de calibración es R*, se obtiene una constante de sonda, C:
La conductividad específica, κ (kappa) es la recíproca de la resistencia específica:
La conductividad también es dependiente de la temperatura.
Fundamento teórico
editarla conductividad de una solución que contiene un electrolito depende de la concentración del electrolito. Por lo tanto es conveniente dividir la conductividad específica por la concentración. Este cociente se denomina conductividad molar, es denota por Λm
donde κ es la conductividad específica y c la concentración del electrólito en moles por cm3.
Electrolitos fuertes
editarLos electrolitos fuertes son capaces de disociarse completamente en solución. La conductividad de una solución de un electrolito fuerte a baja concentración sigue la ley de Kohlrausch:
donde se conoce como la conductividad molar límite, es decir, "en el límite de la dilución infinita" , K es una constante empírica y c es la concentración de electrolito, como ya se ha indicado.
Por otra parte, Kohlrausch también encontró que la conductividad límite de aniones y cationes son aditivas: la conductividad de una solución de sal es igual a la suma de las contribuciones a la conductividad de los cationes y los aniones.
donde:
- y son el número de moles de cationes y aniones, respectivamente, que se crean en la disociación de 1 mol del electrolito disuelto;
- y son las conductividades molares límite de los iones individuales.
La tabla siguiente da los valores de las conductividades molares límite de iones seleccionados.
Conductividad límite de algunos iones en agua (25 °C) Cationes λ+0 /mS m²mol-1 Aniones λ-0 /mS m²mol-1 H+ 34.96 OH- 19.91 Li+ 3.869 Cl- 7.634 Na+ 5.011 Br- 7.84 K+ 7.350 I- 7.68 Mg2+ 10.612 SO42- 15.96 Ca2+ 11.900 NO3- 7.14 Ba2+ 12.728 CH3CO2- 4.09
Una interpretación teórica de estos resultados fue proporcionada por la ecuación de Debye-Hückel-Onsager.[8]
donde A y B son constantes que dependen solamente de variables conocidas como temperatura, cargas de los iones y la constante dieléctrica y la viscosidad del disolvente. Como el nombre sugiere, esta es una extensión de la teoría de Debye–Hückel, debida a Onsager. Es un gran éxito para soluciones a baja concentración.
Electrolitos débiles
editarUn electrolito débil es aquel que no está totalmente disociado. Típicos electrolitos débiles son los ácidos débiles y las bases débiles. La concentración de iones en una solución de un electrolito débil es menor que la concentración de dicho electrolito. Para los ácidos y las bases la concentración puede calcularse cuando se conoce el valor o los valores de las constantes de disociación ácida.
Para un ácido monoprótico, HA, con una constante de disociación , se puede obtener una expresión explícita para la conductividad como una función de la concentración, c, conocida como ley de dilución de Ostwald.
Concentraciones elevadas
editarTanto la ley de Kolrausch como la ecuación de Debye-Hückel-Onsager describe lo que ocurre cuando la concentración de electrolito aumenta por encima de cierto valor. La razón es que cuando la concentración aumenta la distancia media entre cationes y aniones disminuye, de modo que hay una mayor interacción iónica. Si ello constituye una asociación de iones es discutible. Sin embargo, a menudo se considera que los cationes y aniones interactúan para formar un par iónico. Así, el electrolito se trata como si fuera un ácido débil y se puede obtener una constante, K, para el equilibrio:
Davies describe los resultados de tales cálculos con gran detalle, pero afirma que K no necesariamente debe ser considerada como una verdadera constante de equilibrio, sino más bien, que la inclusión del término asociación de iones es útil para extender el rango de buena concordancia entre los datos de conductividad teóricos y experimentales.[9] Se han hecho varios intentos para extender el tratamiento de Onsager a soluciones más concentradas.[10]
La existencia del llamado mínimo de conductancia ha demostrado ser un tema controvertido en lo que respecta a la interpretación. Fuoss y Kraus han sugerido que es causado por la formación de tripletes iónicos,[11] y esta sugerencia ha recibido algún soporte recientemente.[12][13]
Aplicaciones
editarA pesar de la dificultad de interpretación teórica, las mediciones de conductividad se utilizan ampliamente en muchas industrias.[14] Por ejemplo, las medidas de conductividad se utilizan para controlar la calidad de los suministros públicos de agua, en hospitales, en el agua de las calderas y en las industrias que dependen de la calidad del agua, tales como en las de elaboración de la cerveza. Este tipo de medición no es específica de iones , ya que a veces se puede utilizar para determinar la cantidad de sólidos totales disueltos (TDS) si se conoce la composición de la solución y su comportamiento de conductividad.[1]
A veces, las mediciones de conductividad están vinculadas con otros métodos para aumentar la sensibilidad de la detección de determinados tipos de iones. Por ejemplo, en la tecnología del agua de caldera, la purga de caldera es continuamente supervisada la conductividad de cationes que es la conductividad del agua después de haber pasado a través de una resina de intercambio catiónico. Este es un método muy sensible para vigilar las impurezas aniónicas en el agua de la caldera, en presencia de exceso de cationes (los del agente alcalinizante usualmente utilizado para el tratamiento de agua). La sensibilidad de este método se basa en la alta movilidad de H+ en comparación con la movilidad de otros cationes o aniones.
Los detectores de conductividad se utilizan habitualmente en la cromatografía iónica.[15]
Véase también
editar- Efecto Debye–Falkenhagen
- Svante August Arrhenius
- Alfred Werner – química de coordinación
- Conductímetro
- Conductimetría
- Valoración conductimétrica – métodos para determinar el punto de equivalencia
Referencias
editar- ↑ a b Gray, James R. (2004). «Conductivity Analyzers and Their Application». En Down, R.D; Lehr, J.H., ed. Environmental Instrumentation and Analysis Handbook. Wiley. pp. 491-510. ISBN 978-0-471-46354-2. Consultado el 10 de mayo de 2009.
- ↑ http://www.lenntech.com/water-conductivity.htm
- ↑ Bockris, J. O'M.; Reddy, A.K.N; Gamboa-Aldeco , M. (1998). Modern Electrochemistry (2nd. edición). Springer. ISBN 0306455552. Consultado el 10 de mayo de 2009.
- ↑ Marija Bešter-Rogač and Dušan Habe, "Modern Advances in Electrical Conductivity Measurements of Solutions", Acta Chim. Slov. 2006, 53, 391–395 (pdf)
- ↑ Boyes, W. (2002). Instrumentation Reference Book (3rd. edición). Butterworth-Heinemann. ISBN 0750671238. Consultado el 10 de mayo de 2009.
- ↑ Gray, p 495
- ↑ «ASTM D1125 - 95(2005) Standard Test Methods for Electrical Conductivity and Resistivity of Water». Consultado el 12 de mayo de 2009.
- ↑ Wright, M.R. (2007). An Introduction to Aqueous Electrolyte Solutions. Wiley. ISBN 978-0-470-84293-5.
- ↑ Davies, C.W. (1962). Ion Association. London: Butterworths.
- ↑ Miyoshi, K. (1973). «Comparison of the Conductance Equations of Fuoss - Onsager, Fuoss-Hsia and Pitts with the Data of Bis(2, 9-dimethyl-1, 10-phenanthroline)Cu(I) Perchlorate». Bull. Chem. Soc. Japan 46 (2): 426-430. doi:10.1246/bcsj.46.426.
- ↑ Fuoss, R.M.; Kraus, C.A. (1935). «Properties of Electrolytic Solutions. XV. Thermodynamic Properties of Very Weak Electrolytes». J. Amer. Chem. Soc. 57: 1-4.
- ↑ Weingärtner, H.; Weiss, V.C.; Schröer, W. (2000). «Ion association and electrical conductance minimum in Debye–Hückel-based theories of the hard sphere ionic fluid». J. Chem. Phys. 113 (2): 762-. doi:10.1063/1.481822.
- ↑ Schröer, W.; Weingärtner, H. (2004). «Structure and criticality of ionic fluids». Pure Appl. Chem. 76 (1): 19-27. doi:10.1351/pac200476010019. pdf
- ↑ «Electrolytic conductivity measurement, Theory and practice». Aquarius Technologies Pty Ltd. Archivado desde el original el 12 de septiembre de 2009.
- ↑ «Detectors for ion-exchange chromatography». Archivado desde el original el 20 de agosto de 2009. Consultado el 17 de mayo de 2009.
Enlaces externos
editar- Esta obra contiene una traducción derivada de «conductivity (electrolytic)» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Cole-Parmer Technical Library Conductivity