Dióxido de plutonio
El dióxido de plutonio (óxido de plutonio (IV)) es un óxido de plutonio con fórmula química PuO2. En forma sólida, es caliente al tacto debido a desintegración alfa. Puede variar en color de amarillo a verde oliva, dependiendo del tamaño de partícula, temperatura y método de producción.[2] El dióxido de plutonio-238 es usado como combustible nuclear en varias naves espaciales como la sonda 'New Horizons' y el rover Curiosity en Marte.
| Dióxido de plutonio | ||
|---|---|---|
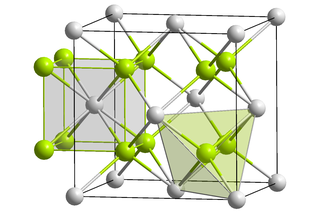
 Estructura cristalina del dióxido de plutonio en el grupo espacial Fm-3m. | ||
 | ||
| Nombre IUPAC | ||
| Dióxido de plutonio | ||
| General | ||
| Otros nombres |
Óxido de plutonio (IV) Anhídrido de plutonio Óxido de plutonio (4+) | |
| Fórmula semidesarrollada | PuO2 | |
| Fórmula molecular | PuO2 | |
| Identificadores | ||
| Número CAS | 12059-95-9[1] | |
| ChemSpider | 10617028 | |
| PubChem | 9795444 | |
|
[O-2].[O-2].[Pu+4]
| ||
| Propiedades físicas | ||
| Apariencia | Cristales de amarillo oscuro | |
| Densidad | 11 500 kg/m³; 11,5 g/cm³ | |
| Masa molar | 276 g/mol | |
| Punto de fusión | 3017 K (2744 °C) K | |
| Punto de ebullición | 3070 K (2797 °C) K> | |
| Estructura cristalina |
Parecida a la Fluorita (cúbica), cF12
a = 540 pm | |
| Propiedades químicas | ||
| Solubilidad en agua | Insoluble | |
| Peligrosidad | ||
| Punto de inflamabilidad | No inflamable | |
| NFPA 704 |
0
4
0
RA
| |
| Riesgos | ||
| LD50 | 400 mg/kg | |
| Compuestos relacionados | ||
| Compuestos relacionados |
Nitrato de plutonio (IV) Plutonoceno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura
editarPuO2 cristaliza en el estilo de la fluorita, organizados en una matriz cúbica centrada en las caras donde el centro lo ocupa el ion Pu4+ y los iones de oxígeno ocupan los agujeros tetraédricos.[3]
En la fisión nuclear, el átomo de plutonio se divide en dos. El producto de la fisión se conserva en la estructura permitiendo que el cristal mantenga su integridad estructural. Este comportamiento hace que el PuO2 sea útil como combustible nuclear.[cita requerida]
Propiedades
editarEl dióxido de plutonio es un material cerámico estable con una solubilidad en agua extremadamente baja y con un alto punto de fusión (2744 °C). Al realizar el método del estudio de fusión rápida con láser el valor de fusión resultó más elevado. Esto es porque ese método evita la contaminación por cualquier material del recipiente.[4]
Debido a la desintegración alfa radiactiva del plutonio, la PuO2 es caliente al tacto. Como ocurre con todos los compuestos de plutonio, está sujeto a control en virtud del Tratado de No Proliferación Nuclear.
Síntesis
editarEl plutonio metálico se oxida espontáneamente a PuO2 en una atmósfera de oxígeno. El dióxido de plutonio se produce principalmente mediante la calcinación de oxalato de plutonio (IV), Pu(C2O4)2·6H2O, a 300 °C. El oxalato de plutonio se obtiene durante el reprocesamiento de combustible nuclear cuando el plutonio se disuelve en HNO3/HF.[5] El dióxido de plutonio también se puede recuperar de los reactores de sal fundida (un tipo de reactor nuclear de fisión) agregando carbonato de sodio a la sal combustible después de que el uranio haya sido eliminado de la sal.
Aplicaciones
editarGeneración eléctrica
editarPuO2, junto con UO2, se utiliza en el combustible nuclear de mezcla de óxidos para reactores nucleares. El dióxido de plutonio-238 se utiliza como combustible para varias naves espaciales del espacio profundo, como la sonda 'New Horizons', así como en el rover Curiosity en Marte. El isótopo se desintegra emitiendo partículas α, que luego generan calor (véase generador termoeléctrico de radioisótopos).
Existe preocupación de que algún accidente durante el reingreso de las naves espaciales a la Tierra resulté en la dispersión de plutonio en el medio ambiente generando contaminación. Esto ocurrió en el fracaso del lanzamiento Transit 5-BN-3 en 1964 (los generadores termoeléctricos de plutonio de primera generación a bordo se desintegró al reentrada y material radiactivo disperso en la atmósfera al norte de Madagascar)[6] Esto provocó un rediseño de los generadores termoeléctricos de radioisótopos. Luego del rediseño, no ha ocurrido esa temida contaminación, pero sí ha habido accidentes en dos naves espaciales con generador termoeléctrico de PuO2; el Nimbus B-1 en mayo de 1968 y el Módulo Lunar del Apolo 13 en abril de 1970.[7][8] Los generadores termoeléctricos de ambas naves espaciales reingresaron intactos, y no se observó contaminación ambiental en ninguno de los casos.
Bomba nuclear
editarSe ha demostrado que un arma nuclear de bajo rendimiento (1 kilotón) se podía fabricar con relativa facilidad a partir de óxido de plutonio.[9] Una bomba de óxido de plutonio tendría una masa crítica considerablemente mayor que una fabricada con plutonio metálico (casi tres veces más grande, incluso con el óxido en la máxima densidad cristalina; si el óxido estuviera en forma de polvo, como suele ocurrir, la masa crítica sería ser aún mayor), debido a la menor densidad del plutonio en PuO2 en comparación con el plutonio metálico y a la masa inerte que añade el oxígeno contenido en el óxido.[10]
Toxicología
editarEl comportamiento del óxido de plutonio en el organismo varía según la forma en que se ingiera. Dado que es insoluble, cuando se ingiere, un gran porcentaje se eliminará del cuerpo con bastante rapidez en los desechos corporales.[11] El óxido de plutonio con partículas de tamaño inferior a 10 micrómetros (0,01 mm)[12] es tóxico si se inhala debido a su emisión alfa.[13]
Véase también
editarReferencias
editar- ↑ Número CAS
- ↑ «Nitric acid processing». Los Alamos Laboratory.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 1471. ISBN 978-0-08-022057-4.
- ↑ De Bruycker, F.; Boboridis, K.; Pöml, P.; Eloirdi, R.; Konings, R. J. M.; Manara, D. (2011). «The melting behaviour of plutonium dioxide: A laser-heating study». Journal of Nuclear Materials 416 (1–2): 166-172. Bibcode:2011JNuM..416..166D. doi:10.1016/j.jnucmat.2010.11.030.
- ↑ Jeffrey A. Katalenich Michael R. Hartman Robert C. O’Brien Steven D. Howe (Feb 2013). «Fabrication of Cerium Oxide and Uranium Oxide Microspheres for Space Nuclear Power Applications». Proceedings of Nuclear and Emerging Technologies for Space 2013: 2. Archivado desde el original el 7 de octubre de 2016. Consultado el 22 de octubre de 2021.
- ↑ «Transit». Encyclopedia Astronautica. Consultado el 7 de mayo de 2013.
- ↑ A. Angelo Jr. and D. Buden (1985). Space Nuclear Power. Krieger Publishing Company. ISBN 0-89464-000-3.
- ↑ «General Safety Considerations» (PDF lecture notes). Fusion Technology Institute, University of Wisconsin–Madison. Spring 2000. Archivado desde el original el 15 de septiembre de 2018. Consultado el 22 de octubre de 2021.
- ↑ Michael Singer (26 de noviembre de 1979). «Nuclear Nightmare: America's Worst Fear Come True». New York Magazine.
- ↑ Sublette, Carey. «4.1 Elements of Fission Weapon Design». The Nuclear Weapon Archive. 4.1.7.1.2.1 Plutonium Oxide. Consultado el 20 de octubre de 2017. «The critical mass of reactor grade plutonium is about 13.9 kg (unreflected), or 6.1 kg (10 cm nat. U) at a density of 19.4. A powder compact with a density of 8 would thus have a critical mass that is (19.4/8)^2 time higher: 82 kg (unreflected) and 36 kg (reflected), not counting the weight of the oxygen (which adds another 14%). If compressed to crystal density these values drop to 40 kg and 17.5 kg.»
- ↑ United States Nuclear Regulatory Commission, Fact sheet on plutonium (accessed Nov 29 2013)
- ↑ World Nuclear Society, Plutonium Archivado el 18 de agosto de 2015 en Wayback Machine. (accessed Nov 29 2013)
- ↑ «Toxicological Profile For Plutonium». U.S. Department of Health and Human Services. 27 de septiembre de 2007. Consultado el 23 de abril de 2009.
