Fluticasona
La fluticasona es un glucocorticoide sintético que se utiliza para tratar la congestión nasal.[1]: 574 [2]: 1337 [3]: 124 [4][5]: 600 La fluticasona se comercializa en dos formas esterificadas: el propionato de fluticasona y el furoato de fluticasona, las cuales se utilizan también como antiinflamatorios tópicos y corticosteroides inhalados, y su uso es mucho más frecuente en comparación.[2][3][4][6] La actividad antiinflamatoria de la fluticasona es 9 veces menor que la de la triamcinolona, 9 veces menor que la fluocinolona, 3 veces menor de la betametasona y 2 veces menor que la beclometasona.
| Fluticasona | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
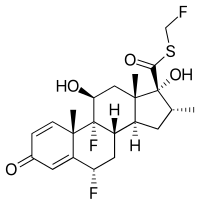
| S-fluorometil (6S,8S,9R,10S,11S,13S,14S,16R,17R)-6,9-difluoro-11,17-dihidroxi-10,13,16-trimetil-3-oxo-6,7,8,11,12,14,15,16-octahidrociclopenta[a]fenantreno-17-carbotiotato | ||
| Identificadores | ||
| Número CAS | 90566-53-3 | |
| Código ATC | D07AC17 R01AD08 R03BA05 R01AD58 | |
| PubChem | 5311101 | |
| DrugBank | DB00588 | |
| ChemSpider | 4470631 | |
| UNII | CUT2W21N7U | |
| KEGG | D07981 | |
| ChEBI | 5134 | |
| ChEMBL | 1201396 | |
| Datos químicos | ||
| Fórmula | C22H27F3O4S | |
| Peso mol. | 444.51 g/mol | |
|
O=C(SCF)[C@]3(O)[C@]2(C[C@H](O)[C@]4(F)[C@@]/1(\C(=C/C(=O)\C=C\1)[C@@H](F)C[C@H]4[C@@H]2C[C@H]3C)C)C
| ||
|
InChI=1S/C22H27F3O4S/c1-11-6-13-14-8-16(24)15-7-12(26)4-5-19(15,2)21(14,25)17(27)9-20(13,3)22(11,29)18(28)30-10-23/h4-5,7,11,13-14,16-17,27,29H,6,8-10H2,1-3H3/t11-,13+,14+,16+,17+,19+,20+,21+,22+/m1/s1
Key: MGNNYOODZCAHBA-GQKYHHCASA-N | ||
| Sinónimos |
6α,9α-Difluoro-11β,17α-dihidroxi-16α-metil-21-tio-21-fluorometilpregna-1,4-dien-3,20-diona S-(Fluorometil)-6α,9α-difluoro-11β,17α-dihidroxi-16α-metil-3-oxoandrosta-1,4-dieno-17β-carbotiotato | |
| Farmacocinética | ||
| Biodisponibilidad | 0.51% (intranasal) | |
| Unión proteica | 91.0% | |
| Metabolismo |
Intranasal Hepático (mediante CYP3A4) | |
| Vida media | 10 h | |
| Excreción | Renal | |
| Datos clínicos | ||
| Cat. embarazo | B3 (AU) No hay estudios en humanos. El fármaco solo debe utilizarse cuando los beneficios potenciales justifican los posibles riesgos para el feto. Queda a criterio del médico tratante. (EUA) | |
| Estado legal | S4 (AU) ℞-only (CA) Grupo IV (Medicamentos expedidos mediante receta médica, autorizados para su venta exclusivamente en farmacias.) (MEX) POM (UK) OTC (EUA) Rx-only en EUA (versiones de patente) | |
| Vías de adm. | Inhalación, intranasal, tópica | |
Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud.[7] En 2022, era el 25º medicamento más recetado en Estados Unidos, con más de 22 millones de recetas,[8][9] aunque también se vende sin receta.[10]
La fluticasona es un corticosteroide sintético de potencia media. Se utiliza tópicamente para aliviar las manifestaciones pruríticas e inflamatorias de algunas dermatosis y psoriasis que responden a los corticoides y por vía intranasal para el tratamiento de las rinitis tanto alérgicas como no alérgicas. Por inhalación, la fluticasona es útil en el tratamiento del asma.
Propionato de fluticasona
editarEl propionato de fluticasona, que se vende bajo las marcas Flovent y Flonase entre otras, es un medicamento esteroide de la familia de los glucocorticoides.[11] Cuando se inhala, se utiliza para el tratamiento a largo plazo del asma y la EPOC.[11] En la nariz, se utiliza para la fiebre del heno y los pólipos nasales.[11][12] También puede utilizarse para las úlceras bucales.[13] Actúa disminuyendo la inflamación.
Los efectos secundarios más comunes cuando se inhala incluyen infecciones del tracto respiratorio superior, sinusitis, candidiasis oral y tos.[11] Los efectos secundarios más comunes cuando se utiliza en la nariz incluyen hemorragia nasal y dolor de garganta.[11] A diferencia del furoato de fluticasona, que está aprobado en niños de hasta dos años de edad cuando se utiliza para las alergias, el propionato de fluticasona sólo está aprobado para niños de cuatro años en adelante.[14][15]
El propionato de fluticasona se patentó en 1980 y se aprobó para uso médico en 1990.[16] Está disponible como medicamento genérico.[12] En 2022, la fluticasona era el 25º medicamento más recetado en Estados Unidos, con más de 22 millones de recetas.
Usos médicos
editarEl propionato de fluticasona se utiliza por inhalación en polvo o aerosol para la profilaxis del asma.[17][11] El aerosol nasal se utiliza para la prevención y el tratamiento de la rinitis alérgica.[18] Las gotas nasales se utilizan en el tratamiento de los pólipos nasales. El aerosol nasal también puede utilizarse en la boca para las úlceras bucales.[13]
El propionato de fluticasona en forma tópica puede utilizarse para tratar afecciones cutáneas como el eccema, la psoriasis y los sarpullidos.[19][20]
El propionato de fluticasona es un éster derivado de la fluticasona. Más concretamente, es el éster resultante de la reacción entre la fluticasona y el ácido propanoico. Esta molécula se utiliza ampliamente en neumología, otorrinolaringología y dermatología.
Neumología
editarEl propionato de fluticasona se utiliza para tratar el asma y la EPOC. Indicado en el asma, los nombres comerciales utilizados son Flixotide (Francia) y Flovent (Estados Unidos).
El propionato de fluticasona también se utiliza en combinación con un agonista del receptor adrenérgico beta 2 para tratar el asma persistente y la EPOC. Las marcas utilizadas son Sérétide (Francia) y Advair (Estados Unidos).
Otorrinolaringología
editarEl propionato de fluticasona se utiliza para tratar la rinitis alérgica. Los nombres comerciales utilizados son Flixonase (Francia) y Flonase (Estados Unidos).
Dermatología
editarEl propionato de fluticasona se utiliza para tratar el eccema, la dermatitis atópica, el liquen plano y la psoriasis. Se utiliza en forma de crema y pomada. El nombre comercial es Flixovate.
Furoato de fluticasona
editarEl furoato de fluticasona, comercializado con el nombre comercial de Flonase Sensimist, entre otros, es un corticosteroide para el tratamiento de la rinitis alérgica y no alérgica administrado en forma de aerosol nasal.[21] También está disponible como corticosteroide inhalado para ayudar a prevenir y controlar los síntomas del asma. Es un derivado del cortisol.[22] A diferencia del propionato de fluticasona, que sólo está aprobado para niños a partir de cuatro años, el furoato de fluticasona está aprobado en niños a partir de dos años cuando se utiliza para las alergias.[14][15]
Su uso médico se aprobó en Estados Unidos en abril de 2007 y en la Unión Europea en noviembre de 2008.[23][24] En 2021, la fluticasona era el 23º medicamento más recetado en Estados Unidos, con más de 25 millones de recetas.
El furoato de fluticasona es un éster derivado de la fluticasona. Más concretamente, es el éster resultante de la reacción entre la fluticasona y el ácido 2-furoico.
Otorrinolaringología
editarEs una molécula indicada para el tratamiento de los síntomas de la rinitis alérgica y se utiliza en forma de suspensión para pulverización nasal. Los nombres comerciales utilizados son Avamys (Francia, Canadá), Veramyst (Estados Unidos), Furamist (India) y Ennhale (India).
Mecanismo de acción
editarComo todos los glucocorticoides, la fluticasona posee propiedades antiinflamatorias, antipruríticas y vasoconstrictoras. En el tratamiento del asma, de las alergias y del asma bronquial crónico, los glucocorticoides reducen las respuestas alérgicas de varios tipos de células (por ejemplo, mastocitos y eosinófilos) implicados en la respuesta alérgica. A nivel molecular, los glucocorticoides libres atraviesan fácilmente las membranas celulares y se unen con alta afinidad a receptores citoplasmáticos específicos. En última instancia, se ven afectadas la transcripción y la síntesis de proteínas. La inflamación se reduce por la disminución de la liberación de hidrolasas ácidas de los leucocitos, la prevención de la acumulación de macrófagos en los sitios inflamados, la interferencia con la adhesión de leucocitos a la pared capilar, reducción de la permeabilidad de la membrana capilar y el posterior edema, la reducción de los componentes del complemento, la inhibición de la histamina y la liberación de cininas, y la interferencia con la formación de tejido cicatricial.
La proliferación de fibroblastos y la deposición de colágeno también se reducen. Se piensa que las acciones antiinflamatorias de los corticoides están mediadas por las proteínas inhibidoras de la fosfolipasa A2, llamadas colectivamente lipocortinas. Las lipocortinas, a su vez, controlan la biosíntesis de mediadores potentes de la inflamación, como las prostaglandinas y los leucotrienos, inhibiendo la liberación de la molécula precursora, el ácido araquidónico. La fluticasona intranasal proporciona un alivio de los síntomas tales como la rinorrea acuosa, la congestión nasal, el goteo nasal, los estornudos y el prurito faríngeo.
La administración tópica sobre la piel reduce la inflamación asociada con las dermatosis agudas o crónicas.
En el tratamiento del asma, los corticosteroides bloquean la respuesta alérgica de fase tardía a los alergenos. Los mediadores implicados en la patogenia del asma incluyen la histamina, los leucotrienos (de liberación lenta de sustancias de la anafilaxia, la SRS-A), el factor quimiotáctico de los eosinófilos de la anafilaxia (ECF-A), factor quimiotáctico de los neutrófilos (NCF), citoquinas, ácidos hidroxieicosa-tetraenoicos, factor prostaglandínico generador de la anafilaxia (PGF-A), las prostaglandinas, la proteína básica mayor, la bradicinina, la adenosina, peróxidos y los aniones superóxido. Diferentes tipos de células son responsables de la liberación de estos mediadores, incluyendo el epitelio de las vías respiratorias, los eosinófilos, los basófilos, el parénquima pulmonar, los linfocitos, los macrófagos, los mastocitos, los neutrófilos, y las plaquetas. Los corticoesteroides inhiben la liberación de estos mediadores, así como la inhibición de síntesis de IgE, atenúan la secreción de moco y la generación de eicosanoides, y hasta regulan los receptores beta, promueven la vasoconstricción y la supresión de la afluencia de células inflamatorias y los procesos inflamatorios. Los efectos clínicos en el asma incluyen una reducción de la hiperreactividad bronquial a los alergenos, una disminución del número de exacerbaciones de asma, y una mejoría en el VEF1, la tasa de flujo máximo, y otros síntomas respiratorios. Puesto que los efectos de corticosteroides toman varias horas o días para convertirse en clínicamente perceptibles, son ineficaces para el tratamiento primario de los ataques broncoespásticos agudos graves o para el estado asmático. Los corticosteroides inhalados no tienen propiedades broncodilatadores.
Farmacocinética
editarEl propionato de fluticasona es administrado ya sea por inhalación oral, o por administración tópica en la piel o la mucosa nasal. La absorción tras la administración tópica a la piel es generalmente mínima y depende de factores tales como el vehículo y la integridad de la epidermis.
Debido principalmente a la absorción desde el pulmón, el aerosol para inhalación oral por lo general resulta en una biodisponibilidad sistémica de aproximadamente el 30% de la dosis suministrada.
La biodisponibilidad del polvo de inhalación oral es de aproximadamente 14%.
El propionato de fluticasona intranasal tiene una biodisponibilidad absoluta de < 2%. Con base en los estudios que utilizan el propionato de fluticasona por vía intravenosa, la distribución es rápida debido a la alta solubilidad en lípidos y vinculante tejido. La fluticasona se une en el 91% a las proteínas del plasma.
La fluticasona se une débilmente y reversiblemente a los eritrocitos y no está vinculada de manera significativa a la transcortina humana.
El metabolismo del propionato de fluticasona se produce por medio del citocromo hepático P450 3A4. Un derivado de ácido carboxílico-17 beta es el único metabolito detectado en el hombre. Este metabolito es significativamente menos activo que el propionato de fluticasona. La excreción es principalmente en las heces como fármaco inalteradol y metabolitos. Menos del 5% de la dosis se excreta en la orina en forma de metabolitos. La vida media de eliminación terminal es de aproximadamente 7,8 horas.
Toxicidad
editarEl propionato de fluticasona estuvo desprovisto de potencial tumorigénico en los estudios de dosis orales de hasta 1.000 mcg/kg (aproximadamente 2 veces la dosis diaria humana máxima inhalación) durante 78 semanas en el ratón o por inhalación de hasta 57 mcg / kg (aproximadamente 1/4 de la dosis máxima diaria humana por inhalación) durante 104 semanas en la rata.
El propionato de fluticasona no indujo mutación de genes en células procariotas o eucariotas in vitro. Ningún efecto clastogénico significativo fue observado en los linfocitos periféricos humanos cultivados in vitro o en la prueba de micronúcleo de ratón. Además, el compuesto no retrasó la división de eritroblastos en la médula ósea.
No se observó ninguna evidencia de deterioro de la fertilidad en los estudios de reproducción realizados en ratas que recibieron dosis subcutáneas de hasta 50 mcg/kg (aproximadamente 1/4 de la dosis diaria humana máxima por inhalación) en machos y en hembras y mujeres. Sin embargo, el peso de la próstata se redujo significativamente en las ratas.
Los estudios subcutáneos en el ratón y la rata con dosis de 45 y 100 mcg/kg, respectivamente (aproximadamente 1/10 y 1/2 de la dosis diaria humana máxima por inhalación, respectivamente), revelaron la toxicidad fetal característica de los compuestos glucocorticoides potentes, como retraso del crecimiento embrionario, onfalocele, fisura palatina, y osificación craneal retardada.
En el conejo, se observó la reducción de peso fetal y el paladar hendido después de dosis subcutáneas de 4 mcg/kg (aproximadamente 1/25 de la dosis diaria máxima en humanos por inhalación). Sin embargo, después de la administración oral de hasta 300 mcg/kg (aproximadamente 3 veces la dosis diaria máxima en humanos por inhalación) de propionato de fluticasona en el conejo, no hubo efectos maternos ni aumento de la incidencia de defectos fetales externos, viscerales o esqueléticos. No se detectó fluticasona en el plasma en este estudio, lo que es consistente con la baja biodisponibilidad tras la administración oral.
Menos de 0,008% de la dosis administrada cruzó la placenta después de la administración oral de 100 mcg/kg a ratas o 300 mcg/kg a conejos (aproximadamente 1/2 y 3 veces la dosis diaria máxima en humanos por inhalación, respectivamente).
Indicaciones y posología
editarPara el tratamiento del prurito y la inflamación tópica asociada con moderada a las dermatosis que responden a corticosteroides graves, incluyendo el tratamiento de la dermatitis atópica, eczema (incluyendo eczema hiperqueratósico, eczema numular y condiciones eczematosas graves de las manos o los pies), dermatitis exfoliativa generalizada, la micosis fungoide, pompholyx (dishidrosis), pénfigo, dermatitis por contacto severa, dermatitis severa Rhus por plantas como la hiedra venenosa, el lupus eritematoso discoide, liquen plano cutáneo, liquen simple crónico, liquen estriado, xerosis, dermatitis seborreica y psoriasis:
Administración tópica (crema o pomada):
- Adultos y adolescentes: 0.005% pomada aplicada con moderación sobre la zona afectada 2 veces al día. O bien, usar crema al 0.05% aplicada con poca frecuencia sobre la zona afectada 2 veces al día. Cada ciclo de tratamiento puede continuar durante un máximo de 4 semanas. En el tratamiento de la psoriasis, los estudios sugieren que los pacientes responden preferentemente a la pomada al 0,005%. En el tratamiento del eczema, las aplicaciones de una vez al día de la crema de fluticasona 0,05% son tan eficaces como el doble de aplicaciones diarias.
- Niños y bebés > 3 meses de edad: utilizar crema de fluticasona al 0,05% aplicada con moderación a la zona afectada una vez al día o dos veces al día. La crema de fluticasona al 0,05% sólo ha sido aprobada para el tratamiento de la dermatitis atópica en esta población. En los ensayos clínicos, las dosis de propionato de fluticasona al 0.05% en crema una vez al día se han aplicado en niños para el tratamiento de la dermatitis atópica hasta durante 4 semanas.
Para el tratamiento de los síntomas nasales de la rinitis alérgica estacional o perenne o rinitis alérgica perenne:
Administración nasal por inhalación:
- Adultos: 2 pulverizaciones en cada orificio nasal (1 spray = 50 mg) una vez al día para una dosis diaria total de 200 mg. Alternativamente, la dosis puede dividirse en 1 pulverización en cada fosa nasal (100 mg) dos veces al día. Después de los primeros pocos días, la dosis se puede reducir a 100 mg una vez al día.
- Los pacientes más jóvenes (> 12 años de edad) deben comenzar el tratamiento con 1 spray en cada fosa nasal una vez al día (dosis total = 100 mg). Las personas con síntomas graves o que no responden a la dosis más baja se puede iniciar a 200 mg una vez al día. La dosis máxima diaria para todos los pacientes es de 200 mg / día.
- Adolescentes y niños de 4-17 años de edad: 1 pulverización en cada fosa nasal (1 spray = 50 mg) una vez al día hasta una dosis diaria total de 100 mg. La dosis se puede aumentar hasta 2 pulverizaciones en cada orificio nasal una vez al día (es decir, 200 mg / día) si el paciente no responde a la dosis inicial, y luego la dosis debe ajustarse a la baja en función de la respuesta del paciente.
- Niños < 4 años de edad: la dosis segura y efectiva no ha sido establecida.
Para el tratamiento de asma:
NOTA: Diferentes formulaciones de productos proporcionan diferentes cantidades de fármaco activo.
Administración oral aerosol para inhalación:
- Adultos y adolescentes previamente tratados con broncodilatadores sólo: 88 g (1 spray = 44 mg) mediante la inhalación oral 2 veces al día; que no exceda de 440 microgramos 2 veces por día.
- Adultos y adolescentes tratados previamente con otros corticosteroides inhalados: 88-220 microgramos (1 spray = 44 mg o 110 mg) mediante la inhalación oral 2 veces al día; que no exceda de 440 microgramos 2 veces por día.
- Adultos y adolescentes previamente tratados con corticosteroides orales: 880 microgramos (1 spray = 220 microgramos) mediante la inhalación oral 2 veces al día. Después de al menos 1 semana de terapia de fluticasona, una disminución lenta del corticosteroide oral puede ser considerado. Los pacientes deben ser monitorizados para detectar signos de inestabilidad del asma y signos de insuficiencia suprarrenal durante la abstinencia.
- Los niños de 4-11 años de edad: se recomiendan, inicialmente, 44 mg mediante inhalación oral 2 veces por día; no exceder 88 mg (2 actuaciones de 44 mg /aerosol) 2 veces al día.
- Niños < 4 años de edad: la dosis segura y efectiva no ha sido establecida.
Dosificación del polvo para inhalación oral:
- Adultos y adolescentes previamente tratados con broncodilatadores sólo: Inicialmente, 88 mg mrdiante de la inhalación oral 2 veces al día; La dosis total no debe exceder 440 mg
- Adultos y adolescentes tratados previamente con otros corticosteroides inhalados: Inicialmente, 88-220 mg sin exceder de 440 mg
- Adultos y adolescentes que actualmente reciben corticosteroides orales crónicas: Inicialmente, 880 mg mediante la inhalación oral 2 veces al día. Después de al menos 1 semana de tratamiento con la inhalación de fluticasona, puede ser considerada una disminución lenta de la dosis del corticosteroide oral. Los pacientes deben ser monitorizados para detectar signos de inestabilidad del asma y signos de insuficiencia suprarrenal durante la abstinencia. Una vez que reducción de la dosis de corticosteroides orales es completa, la dosis de fluticasona debe reducirse a la dosis efectiva más baja.
- Los niños de 4-11 años de edad previamente tratados con broncodilatadores sólo: la dosis inicial recomendada es de 44 mg mediante la inhalación oral 2 veces al día, sin exceder 88 mg (2 veces al día)
- Los niños de 4-11 años de edad previamente tratados con otros corticosteroides inhalados: dosis inicial recomendada es de 44 mg meddiante la inhalación oral 2 veces al día sin exceder 88 mg 2 veces al día.,
- Los niños de 4-11 años de edad que actualmente reciben corticosteroides orales crónicos: no han sido establecidas directrices de titulación de dosis para la fluticasona.
- Niños < 4 años de edad: la dosis segura y efectiva no ha sido establecida.
Pacientes con insuficiencia renal: no están disponibles directrices específicas para los ajustes de dosis en la insuficiencia renal.
Contraindicaciones y precauciones
editarLa fluticasona está contraindicada en cualquier persona que sea hipersensible al medicamento o a cualquiera de los componentes de los respectivos productos. El polvo para inhalación de fluticasona puede contener lactosa, a la que algunas personas pueden ser intolerantes.
La fluticasona está contraindicada en pacientes con estado asmático u otros tipos de broncoespasmo agudo para los que se requiere una terapia intensiva. Los pacientes deben ser advertidos de que la fluticasona no es para ser utilizada como un broncodilatador y no está indicada para el alivio del broncoespasmo agudo.
La fluticasona debe utilizarse con precaución cuando sustituyen a otros fármacos al ser un corticoide por vía oral; se han reportado muertes debidas a la insuficiencia suprarrenal en pacientes con asma durante y después de dicha transferencia.
Los pacientes tratados con fluticasona requieren un inicio o reanudación de corticosteroides sistémicos durante periodos de estrés o durante los ataques de asma severos. Los médicos deben ser notificados inmediatamente. Debido a que los glucocorticoides pueden producir o agravar el síndrome de Cushing, estos deben evitarse en pacientes con enfermedad de Cushing. Si se produce la supresión HPA, los pacientes requerirán corticosteroides sistémicos durante los períodos de estrés fisiológico. Si se requiere la cirugía, los pacientes deben notificar a todos los proveedores de atención médica que han recibido corticosteroides en los últimos 12 meses.
La fluticasona no debe ser sustituida por la administración de corticosteroides sistémicos, porque la cantidad de fluticasona inhalada que llega a la circulación sistémica es insuficiente para reemplazar los corticoides administrados por vía oral. Se han reportado muertes por insuficiencia suprarrenal en pacientes asmáticos durante y después de dicha transferencia. Aunque el riesgo de desarrollar una supresión hipotalámico-pituitario-adrenal (HPA) es muy bajo con la fluticasona inhalada, los pacientes deben, sin embargo, ser monitorizados por esta posibilidad.
El tratamiento con corticosteroides generalmente no contraindica la vacunación con vacunas de virus vivos, cuando este tipo de terapia es de corto plazo (< 2 semanas) y en dosis bajas a moderadas.
Los efectos inmunosupresores de los esteroides difieren, pero muchos médicos consideran que una dosis equivalente a 2 mg/kg/día o 20 mg/día de prednisona es un inmunosupresor suficientemente como para aumentar la preocupación por la seguridad de la inmunización con vacunas de virus vivos. En general, los pacientes con inmunosupresión severa debido a las grandes dosis de corticosteroides no deben recibir la vacunación con vacunas de virus vivos.
Cuando se considera el uso de quimioterapia contra el cáncer o de medicamentos inmunosupresores (por ejemplo, para los pacientes con enfermedad de Hodgkin o trasplante de órganos), la vacunación debe preceder al inicio de la quimioterapia o la inmunoterapia por > 2 semanas. Los pacientes vacunados durante la terapia inmunosupresora o en las 2 semanas antes de iniciar el tratamiento se deben considerar que no están vacunados y deben ser revacunados al menos 3 meses después de suspender el tratamiento. En pacientes que han recibido altas dosis de corticosteroides sistémicos, durante > 2 semanas, se recomienda esperar al menos 3 meses después de suspender el tratamiento antes de administrar una vacuna de virus vivos.
Aunque los pacientes que reciben terapia con corticosteroides sistémicos son más susceptibles a la infección secundaria que los pacientes que no reciben corticosteroides, la administración por vía inhalada minimiza este riesgo. Ciertas infecciones como la varicela y el sarampión pueden ser más graves en los pacientes inmunodeprimidos. La terapia con corticosteroides puede reactivar la tuberculosis y no deben ser utilizada en pacientes con antecedentes de tuberculosis activa, excepto cuando la quimioprofilaxis se instituye en forma concomitante. Los corticosteroides también deben evitarse en pacientes con infección activa por herpes.
La terapia con corticosteroides puede enmascarar los síntomas de la infección y no debe ser utilizada en casos de infecciones bacterianas o virales que no se controlen adecuadamente con agentes antiinfecciosos, excepto en circunstancias que amenacen la vida. El efecto de los corticosteroides inhalados orales o nasales sobre la inmunidad es menos clara. La incidencia o el curso de una infección bacteriana o viral aguda son probablemente mínimamente afectados por los corticosteroides inhalados en los individuos inmunocom-petentes. A pesar de sus efectos mínimos sobre la función inmune, la fluticasona inhalada se debe utilizar con precaución en pacientes con infecciones por herpes simplex ocular tuberculosis, cirugía oral o nasal, trauma, curación de las úlceras del tabique nasal, e infecciones no tratadas (virus, hongos o infecciones respiratorias bacterianas).
La fluticasona está contraindicada en pacientes con micosis sistémica.
Los corticosteroides inhalados no deben ser administrados a pacientes con infecciones sistémicas a menos que se administre simultáneamente una quimioterapia apropiada.
Se ha observado la inhibición del crecimiento en algunos niños después de tratamientos con altas dosis de propionato de fluticasona por inhalación. No se conoce el efecto de la fluticasona en la estatura adulta final. Los niños que reciben tratamiento por inhalación con fluticasona deben ser monitorizados estrechamente para determinar posibles efectos adversos en los patrones de crecimiento.
La seguridad y eficacia de las inhalaciones de fluticasona no han sido determinadas para los niños menores de 4 años de edad. Los niños y los bebés pueden absorber proporcionalmente mayores cantidades de corticosteroides tópicos debido a un área de superficie de la piel mayor en proporción al peso corporal, y por lo tanto son más susceptibles a desarrollar toxicidad sistémica, sobre todo con productos de alta potencia. Se han reportado la supresión del eje hipotalámico-pituitario-adrenal (HPA), el síndrome de Cushing, e la hipertensión intracraneal en niños tratados con cremas y ungüentos a base de corticosteroides tópicos. No se recomiendan las preparaciones de fluticasona tópicas en niños y lactantes menores de 12 años de edad, salvo que los beneficios del tratamiento puedan ser mayores que los riesgos potenciales de la terapia. Existen datos limitados sobre las reacciones adversas y la eficacia.
Los efectos perjudiciales sobre el metabolismo óseo, tales como la osteoporosis son mucho menores con los corticosteroides inhalados que en los de administración sistémica. Aunque no son concluyentes, algunos datos sugieren que altas dosis de esteroides inhalados también pueden disminuir la formación de hueso y aumentar la resorción. Algunos pacientes que reciben esteroides inhalados pueden estar en mayor riesgo de pérdida de masa ósea en comparación con los individuos sanos.
Los ungüentos o cremas a base de fluticasona no deben aplicarse a los pezones o areolas de las mujeres en periodo de lactancia; la ingestión de los corticosteroides tópicos por lactantes a través de esta ruta se ha asociado con efectos sistémicos.
Al igual que con otros corticosteroides tópicos fluorados potentes, las cremas y ungüentos de fluticasona no deben ser usados para tratar el acné vulgar, acné rosácea, o dermatitis perioral. La fluticasona puede agravar estas condiciones.
No se recomiendan las preparaciones tópicas fluticasona para su aplicación en la cara. Se debe tener cuidado para evitar el contorno de ojos, ya que se han reportado casos de discapacidad visual e hipertensión ocular con corticosteroides tópicos.
Se debe tener cuidado al aplicar corticoides tópicos potentes a los ancianos, los pacientes con enfermedad vascular periférica severa, o en áreas de atrofia de la piel. Pueden ocurrir ulceraciones o infecciones en zonas de mala circulación debido a un adelgazamiento de la piel.
La fluticasona se clasifica dentro de la categoría C de riesgo en el embarazo. No se han realizado estudios adecuados y bien controlados sobre el uso de fluticasona durante el embarazo. En general, los corticosteroides atraviesan la placenta, y los estudios en animales han demostrado algunos efectos teratogénicos con la exposición sistémica o subdérmica. Los corticosteroides inhalados son a menudo preferibles a los corticosteroides sistémicos cuando su uso no se puede evitar para el tratamiento del asma durante el embarazo. Sin embargo, el uso de fluticasona durante el embarazo por cualquier vía debe evitarse a menos que el beneficio terapéutico potencial justifique el riesgo añadido para el feto. Las mujeres con asma que quedan embarazadas mientras estabilizan su tratamienton con inhalación de fluticasona deben discutir su manejo del asma con un profesional de la salud calificado.
No se recomienda el uso de cremas y ungüentos con corticoides tópicos fluorados, como la fluticasona, durante el embarazo.
Se recomendienda la máxima precaución en la administración de fluticasona a las mujeres que estén amamantando a sus bebés. La mayoría de los corticoesteroides, incluyendo dosis fisiológicas de la prednisona, se excretan en la leche materna en cantidades mínimas. La Academia Americana de Pediatría ha considerado que por lo general los corticosteroides inhalados y orales equivalentes a dosis de prednisona de 20 mg/día o menos son compatibles con la lactancia. La exposición del lactante a la fluticasona inhalada puede ser minimizada siempre que la lactancia materna tenga lugar a las 4 horas después de una dosis.
Interacciones
editarNo se han comunicado interacciones de otros fármacos con la crema o pomada tópicas de fluticasona.
La administración de ketoconazol, cuando se añade a un régimen existente de fluticasona por inhalación, resulta en un aumento en las concentraciones medias de fluticasona, y la supresión de los niveles de cortisol en plasma. La interacción puede ser debida a la inhibición del isoenzima 3A4 del citocromo P-450 por el ketoconazol, con las posteriores disminuciones en el metabolismo de fluticasona por la misma isoenzima. Se debe tener precaución cuando ketoconazol u otros inhibidores potentes del citocromo P-450 3A4 se prescriben con las inhalaciones de fluticasona; los pacientes pueden necesitar ser observados por si aumentan los efectos secundarios relacionados con los corticosteroides.
El riesgo de toxicidad cardíaca con isoproterenol en pacientes con asma parece aumentar con la administración concomitante de corticosteroides o metilxantinas. Las infusiones intravenosas de isoproterenol en niños asmáticos refractarios a dosis de 0,05 a 2,7 ug/kg/min, han causado un deterioro clínico, infarto de miocardio (necrosis), insuficiencia cardíaca congestiva y muerte.
Las vacunas y toxoides inactivados o muertos no representan un peligro para las personas inmunocomprometidas y generalmente se deben administrar como se recomienda para personas sanas. La respuesta inmune a las vacunas de las personas inmunocomprometidas no es tan buena como la de las personas sanas; pueden ser necesarias dosis más altas o reforzadoras más frecuentes aunque la respuesta inmune todavía puede ser subóptima. Las vacunas de virus vivos no deben administrarse a pacientes inmunocomprometidos debido a la potenciación de la replicación del virus y las reacciones adversas a los virus. Los pacientes bajo tratamiento con corticosteroides en dosis altas no se deben exponer a otras personas que hayan recibido recientemente la vacuna antipoliomielítica oral (OPV). La vacunación frente al sarampión, las paperas y la rubéola (MMR) no está contraindicada para los contactos cercanos, incluidos los profesionales de la salud, de los pacientes inmunocomprometidos. Puede estar indicada la inmunoprofilaxis pasiva con inmunoglobulinas en las personas inmunocomprometidas en lugar de, o además de, la vacunación. Cuando se exponen a una enfermedad prevenible por vacunación, como el sarampión, los niños severamente inmunocomprometidos deben ser considerados susceptibles, independientemente de su historial de vacunación.
Reacciones adversas
editarLa fluticasona presenta un riesgo relativamente bajo de supresión del eje hipotalámico-pituitario-adrenal (HPA) cuando se usa en las dosis recomendadas. Las dosis farmacológicas de fluticasona, administradas por períodos prolongados pueden, sin embargo, dar lugar a insuficiencia suprarrenal. Los síntomas de hiperadrenocorticismo (por ejemplo, el síndrome de Cushing) pueden ocurrir si las dosis recomendadas de fluticasona se exceden o si los pacientes son particularmente sensibles a los efectos de la fluticasona.
La absorción sistémica de fluticasona ejerce un efecto de retroalimentación negativa sobre la pituitaria, inhibiendo de este modo la secreción de adrenocorticotropina (ACTH). Esto resulta en una disminución en la síntesis de los corticosteroides endógenos y andrógenos mediada por ACTH de la corteza suprarrenal. La gravedad de la insuficiencia suprarrenal secundaria inducida por glucocorticoides varía entre los individuos y es dependiente de la dosis, frecuencia, tiempo y vía de administración, y la duración de la terapia. Los pacientes con supresión HPA requerirán dosis de corticosteroides aumentadas durante los períodos de estrés excesivo.
La supresión suprarrenal y la inhibición del crecimiento se han observado en algunos niños después de la terapia con altas dosis de propionato de fluticasona. La inhibición del crecimiento se ha observado en ausencia de evidencia de laboratorio de supresión del eje hipotalámico-pituitario-adrenal (HPA), lo que sugiere que la velocidad de crecimiento es un indicador más sensible de la exposición de corticosteroides sistémicos en pacientes pediátricos.
Con los corticosteroides inhalados por vía oral, la reducción media en la velocidad de crecimiento es de aproximadamente un centímetro por año (rango 0,3 a 1,8 cm por año) y parece estar relacionada con la dosis y la duración de la exposición. Los efectos a largo plazo de esta reducción en la velocidad de crecimiento, incluyendo el impacto sobre la estatura adulta final, son desconocidos.
Para minimizar los efectos de los corticosteroides intranasales, cada paciente debe ajustarse a la dosis efectiva más baja.
Las reacciones adversas más comunes que ocurren en > 1% de los pacientes tratados por fluticasona intranasal incluyen epistaxis, ardor nasal, secreciones nasales sanguinolentas, dolor de cabeza, irritación nasal y picazón, y faringitis. Otras reacciones adversas que ocurren en < 1% de los pacientes que tratados con fluticasona intranasal incluyen bronquitis, mareo, lagrimeo (epífora), rinorrea, sequedad nasal congestión nasal, excoriación nasal o úlcera, náuseas / vómitos, sinusitis, estornudos, urticaria, y xerostomía.
La perforación del tabique nasal es una complicación rara, pero grave de los esteroides intranasales.
Las reacciones adversas comunes a la inhalación oral de fluticasona incluyen faringitis (10-14%), congestión nasal (8-16%), sinusitis (3-6%), disfonía (3-8%) y cefalea (17-22%). Esos efectos adversos que ocurren en el 1-3% de los pacientes tratados con fluticasona inhalada por vía oral incluyen artralgias, bronquitis, congestión en el pecho, problemas dentales, diarrea, mareos, dismenorrea, dispepsia, fiebre, mareos, irritación ocular, náuseas/vómitos, erupción exantema/ piel, rinalgia, y el trastornos del estómago.
La incidencia de reacciones adversas se incrementa con la administración de dosis diarias más elevadas. La inmunosupresión local asociada con el uso de fluticasona inhalado puede manifestarse como un crecimiento excesivo de hongos en la nariz, boca y garganta. La candidiasis oral (afta) es una reacción adversa bien conocida de la terapia con esteroides por inhalación oral y se produce en el 2-5% de los pacientes tratados con fluticasona inhalada. La incidencia puede ser correlacionada con la dosis diaria, y parece ocurrir con menos frecuencia en los niños.
El uso de un dispositivo espaciador, la reducción de la frecuencia de uso, y el enjuagarse la boca después de su uso se puede reducir al mínimo la incidencia de la candidiasis orofaríngea. [
Los tratamientos con corticosteroides inhalados se ha asociado con el desarrollo de cataratas en los adultos. El riesgo de cataratas aumenta con la duración del tratamient y las dosis altas de los corticosteroides inhalados. El mecanismo de formación de cataratas inducidas por corticosteroides es incierto, pero puede implicar la interrupción de las bombas de sodio-potasio en el epitelio de la lente que conduce a accumulación de agua en las fibras del cristalino y la aglutinación de las proteínas.
Las preparaciones tópicas de fluticasona pueden estar asociados con efectos adversos locales que incluyen erupción acneiforme, dermatitis alérgica de contacto, foliculitis, hipertricosis, maceración de la piel, miliaria, dermatitis perioral, prurito, infección secundaria, atrofia de la piel, hipopigmentación de la piel, estrías, y xerosis. Otros efectos dermatológicos incluyen eritema, hiperestesia, púrpura, úlcera cutánea, telangiectasia y vesiculación.
Puede desarrollarse tolerancia con el uso prolongado de formulaciones de corticosteroides tópicos. Esto puede explicar las respuestas dramáticas observadas inicialmente por los pacientes al principio del tratamiento y una disminución de la respuesta evidente con el tiempo. La tolerancia es reversible y puede ser atenuada por la aplicación cíclica de cremas o ungüentos con períodos de reposo.
Las reacciones de hipersensibilidad con fluticasona son raras. Se han reportado urticaria y broncoespasmo con el uso de la fluticasona inhalado. En casos raros, los pacientes tratados con fluticasona inhalada pueden presentar eosinofilia y características clínicas de vasculitis, consistentes con el síndrome de Churg-Strauss, una condición que a menudo aparece en los sujetos tratados con corticosteroides sistémicos. Casos similares se han reportado con el uso de otros corticosteroides inhalados. Una relación causal con fluticasona aún no ha sido establecida.
Véase también
editarReferencias
editar- ↑ Elks, J.; Ganellin, C. Robin (1990). The Dictionary of Drugs: Chemical Data, Structures and Bibliographies (en inglés). Nueva York: Springer. ISBN 978-1-4757-2085-3. Consultado el 4 de diciembre de 2024.
- ↑ a b Index Nominum 2000: International Drug Directory (en inglés) (17ma edición). Berna: Taylor & Francis. 2000. ISBN 978-3-88763-075-1. Consultado el 4 de diciembre de 2024.
- ↑ a b Morton, Ian K. M.; Hall, Judith M. (1999). Concise Dictionary of Pharmacological Agents: Properties and Synonyms (en inglés). Dordrecht: Springer. ISBN 978-94-011-4439-1. Consultado el 4 de diciembre de 2024.
- ↑ a b «Fluticasone - FDA prescribing information, side effects and uses». Drugs.com (en inglés). Nueva Zelanda: Drugsite Trust. 10 de noviembre de 2024. Consultado el 4 de diciembre de 2024.
- ↑ Briggs, Gerald G.; Freeman, Roger K.; Yaffe, Sumner J. (7 de enero de 2011). Drugs in Pregnancy and Lactation: A Reference Guide to Fetal and Neonatal Risk (en inglés) (novena edición). Lippincott Williams & Wilkins. ISBN 978-1451153590. Consultado el 4 de diciembre de 2024.
- ↑ Spratto, George R.; Woods, Adrienne L. (29 de junio de 2011). Delmar Nurse’s Drug Handbook 2012 Edition (en inglés). Cengage Learning. p. 748. ISBN 978-1111310653.
- ↑ Organización Mundial de la Salud (2023). «The selection and use of essential medicines 2023: web annex A: World Health Organization model list of essential medicines: 23rd list (2023)» (en inglés). Ginebra: OMS. Consultado el 4 de diciembre de 2024.
- ↑ «The Top 300 of 2022». ClinCalc.com (en inglés). 30 de agosto de 2024. Consultado el 4 de diciembre de 2024.
- ↑ «Fluticasone Drug Usage Statistics, United States, 2013 - 2022». ClinCalc.com (en inglés). 30 de agosto de 2024. Consultado el 4 de diciembre de 2024.
- ↑ «Fluticasone Nasal Spray: Package Insert / Prescribing Info». Drugs.com (en inglés). Nueva Zelanda: Drugsite Trust. 10 de noviembre de 2024. Consultado el 4 de diciembre de 2024.
- ↑ a b c d e f American Society of Health-System Pharmacists (10 de noviembre de 2024). «Fluticasone Propionate Monograph for Professionals». Drugs.com (en inglés). Nueva Zelanda: Drugsite Trust. Consultado el 4 de diciembre de 2024.
- ↑ a b British National Formulary (21 de septiembre de 2018). BNF 76: September 2018 - March 2019 (en inglés) (76 edición). Pharmaceutical Press. pp. 262, 1172. ISBN 9780857113382.
- ↑ a b «Flixonase aqueous spray» (PDF). Sheffield Teaching Hospitals (en inglés). Sheffield: National Health Service Foundation Trust. junio de 2018. Archivado desde el original el 25 de septiembre de 2019. Consultado el 4 de diciembre de 2024.
- ↑ a b «Flonase Sensimist Allergy Relief- fluticasone furoate spray, metered». DailyMed (en inglés). Biblioteca Nacional de Medicina de Estados Unidos. 22 de marzo de 2024. Consultado el 4 de diciembre de 2024.
- ↑ a b «Veramyst- fluticasone furoate spray, metered». DailyMed (en inglés). Biblioteca Nacional de Medicina de Estados Unidos. 1 de abril de 2010. Consultado el 4 de diciembre de 2024.
- ↑ Fischer, János; Ganellin, C. Robin (13 de diciembre de 2006). Analogue-based Drug Discovery (en inglés). Wiley. p. 487. ISBN 9783527607495. Consultado el 4 de diciembre de 2024.
- ↑ «Flovent Diskus- fluticasone propionate powder, metered». DailyMed (en inglés). Biblioteca Nacional de Medicina de Estados Unidos. 11 de agosto de 2023. Consultado el 5 de diciembre de 2024.
- ↑ [Flonase Allergy Relief FDA label «Flonase Allergy Relief- fluticasone propionate spray, metered»]
|url=incorrecta (ayuda). DailyMed (en inglés). Biblioteca Nacional de Medicina de Estados Unidos. 24 de septiembre de 2024. Consultado el 5 de diciembre de 2024. - ↑ «Fluticasone PROPIONATE Cream - Uses, Side Effects, and More». WebMD (en inglés). Internet Brands. Consultado el 5 de diciembre de 2024.
- ↑ Lax, Stephanie J; Harvey, Jane; Axon, Emma; Howells, Laura; Santer, Miriam; Ridd, Matthew J; Lawton, Sandra; Langan, Sinéad; Roberts, Amanda; Ahmed, Amina; Muller, Ingrid; Ming, Long Chiau; Panda, Saumya; Chernyshov, Pavel; Carter, Ben; Williams, Hywel C; Thomas, Kim S; Chalmers, Joanne R (11 de marzo de 2022). «Strategies for using topical corticosteroids in children and adults with eczema» (PDF). Cochrane Database of Systematic Reviews (en inglés) (Colaboración Cochrane) 2022 (3): CD013356. PMC 8916090. PMID 35275399. doi:10.1002/14651858.CD013356.pub2.
- ↑ Bruni, Francesca Maria; De Luca, Giuseppina; Venturoli, Vico; Boner, Attilio Loris (29 de junio de 2009). «Intranasal Corticosteroids and Adrenal Suppression». Neuroimmunomodulation (en inglés) (Karger Publishers) 16 (5): 353-362. PMID 19571596. doi:10.1159/000216193. Consultado el 4 de diciembre de 2024.
- ↑ Meltzer, Eli O. (2011). «8. The Role of Nasal Corticosteroids in the Treatment of Rhinitis». En Kaliner, Michael A.; Alam, Rafaeul, eds. Rhinitis, An Issue of Immunology and Allergy Clinics - E-Book (en inglés). Elsevier Health Sciences. p. 548. ISBN 9781455709328. Consultado el 4 de diciembre de 2024.
- ↑ FDA (16 de julio de 2012). «Drug Approval Package: Veramyst (fluticasone furoate) NDA #022051». FDA-Approved Drugs (en inglés). Consultado el 4 de diciembre de 2024.
- ↑ EMA (30 de mayo de 2024). «Avamys EPAR». Medicines - European Medicines Agency (EMA) (en inglés). Consultado el 4 de diciembre de 2024.
Enlaces externos
editar- Esta obra contiene una traducción parcial derivada de «Fluticasone» de Wikipedia en inglés, concretamente de esta versión del 5 de noviembre de 2024, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Esta obra contiene una traducción parcial derivada de «Fluticasone propionate» de Wikipedia en inglés, concretamente de esta versión del 26 de septiembre de 2024, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Wikimedia Commons alberga una categoría multimedia sobre Fluticasona.
- Centro colaborador de La Administración Nacional de Medicamentos, alimentos y Tecnología Médica -ANMAT - FLUTICASONA EN VADEMECUM