Geometría molecular
La geometría molecular o estructura molecular se refiere a la disposición tridimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc. Actualmente, el principal modelo es la teoría de repulsión de pares de electrones de valencia (TRPEV), empleada internacionalmente por su gran predictibilidad.
Determinación de la geometría molecular
editarLas geometrías moleculares se determinan mejor cuando las muestras están próximas al cero absoluto porque a temperaturas más altas las moléculas presentarán un movimiento rotacional considerable. En el estado sólido la geometría molecular puede ser medida por difracción de rayos X. Las geometrías se pueden calcular por procedimientos mecánico cuánticos ab initio o por métodos semiempíricos de modelamiento molecular.
La posición de cada átomo se determina por la naturaleza de los enlaces químicos con los que se conecta a sus átomos vecinos. La geometría molecular puede describirse por las posiciones de estos átomos en el espacio, mencionando la longitud de enlace de dos átomos unidos, ángulo de enlace de tres átomos conectados y ángulo de torsión de tres enlaces consecutivos.
Movimiento atómico
editarDado que el movimiento de los átomos en una molécula está determinado por la mecánica cuántica, uno debe definir el «movimiento» de una manera cuántica.
Los movimientos cuánticos (externos) de traslación y rotación cambian fuertemente la geometría molecular. (En algún grado la rotación influye en la geometría por medio de la fuerza de Coriolis y la distorsión centrífuga, pero son despreciables en la presente discusión).
Un tercer tipo de movimiento es la vibración , un movimiento interno de los átomos en una molécula. Las vibraciones moleculares son armónicas (al menos en una primera aproximación), lo que significa que los átomos oscilan en torno a su posición de equilibrio, incluso a la temperatura del cero absoluto. En el cero absoluto todos los átomos están en su estado vibracional basal y muestran movimiento mecánico cuántico de punto cero, esto es, la función de onda de un modo vibracional simple no es un pico agudo, sino un exponencial de ancho finito. A temperaturas mayores, los modos vibracionales pueden ser excitados térmicamente (en un interpretación clásica, esto se expresa al enunciar que «las moléculas vibrarán más rápido»), pero siempre oscilan alrededor de una geometría reconocible para la molécula.
Para tener una comprensión más clara de la probabilidad de que la vibración de una molécula pueda ser térmicamente excitada, se inspecciona el factor de Boltzmann , donde es la energía de excitación del modo vibracional, es la constante de Boltzmann y es la temperatura absoluta. A 298K (25 °C), unos valores típicos del factor de Boltzmann son: ΔE = 500 cm-1 --> 0.089; ΔE = 1000 cm-1 --> 0.008; ΔE = 1500 cm-1 --> 7 10-4. Esto es, si la energía de excitación es 500 cm-1, aproximadamente el 9% de las moléculas están térmicamente excitadas a temperatura ambiente. La menor energía vibracional de excitación es el modo de flexión (aproximadamente 1600 cm-1). En consecuencia, a temperatura ambiente menos del 0,07% de todas las moléculas de una cantidad dada de agua vibrarán más rápido que en el cero absoluto.
Como se mencionó anteriormente, la rotación influye fuertemente sobre la geometría molecular. Pero, como movimiento mecánico cuántico, se excita a bajas temperaturas (comparada con la vibración). Desde un punto de vista clásico, puede decirse que más moléculas rotan más rápidamente a temperatura ambiente, esto es que tienen mayor velocidad angular y momentum angular. En lenguaje de mecánica cuántica: más «eigenstates» de alto momentum angular son poblados térmicamente al aumentar la temperatura. Las energías de excitación rotacionales típicas están en el orden de unos pocos cm-1.
Los resultados de muchos experimentos espectroscópicos están ensanchados porque involucran una media de varios estados rotacionales. Frecuentemente es difícil obtener las geometrías a partir de los espectros a altas temperaturas, porque el número de estados rotacionales rastreados en el experimento aumenta al incrementarse la temperatura. En consecuencia, muchas observaciones espectroscópicas solo se puede esperar que conduzcan a geometrías moleculares confiables a temperaturas cercanas al cero absoluto.
Enlaces atómicos
editarPor definición, los átomos en las moléculas suelen estar unidos unos a otros con enlaces covalentes, que pueden ser simples, dobles o triples, donde un «enlace» es un par de electrones compartidos entre átomos vecinos. Otro método de unión entre átomos se denomina enlace iónico en el que intervienen cationes positivos y aniones negativos, sin que se formen moléculas sino redes iónicas.
La geometría molecular puede ser especificada en términos de longitud de enlace, ángulo de enlace y ángulo torsional. La longitud de enlace está definida como la distancia media entre los centros de dos átomos enlazados en una molécula dada. Un ángulo de enlace es el ángulo formado por tres átomos enlazados consecutivamente. Para cuatro átomos unidos consecutivamente en una cadena línea, el ángulo torsional es el ángulo entre el plano formado por los tres primeros átomos y el plano formado por los tres últimos átomos.
Isómeros
editarLos isómeros son tipos de moléculas que comparten la misma fórmula química, pero que tienen diferentes geometrías, resultando en propiedades muy distintas:
- Una sustancia "pura" está compuesta de solo un tipo de isómero de una molécula (todas tienen la misma estructura geométrica).
- Los isómeros estructurales tienen la misma fórmula química, pero diferente ordenamiento físico, frecuentemente formando geometrías moleculares alternas con propiedades muy diferentes. Los átomos no están enlazados (conectados) en el mismo orden.
- Los isómeros funcionales son una clase especial de isómeros estructurales, donde ciertos grupos de átomos exhiben un tipo especial de comportamiento, como es un éter o un alcohol.
- Los estereoisómeros pueden tener muchas propiedades físicoquímicas idénticas y, al mismo tiempo, actividad biológica muy diferente. Esto se debe a que poseen la quiralidad que es muy común en los sistemas vivientes. Una manifestación de esta quiralidad es su habilidad para hacer rotar la luz polarizada en direcciones diferentes.
- Plegamiento de proteínas, que concierne a la compleja geometría y diferentes isómeros que las proteínas pueden tener.
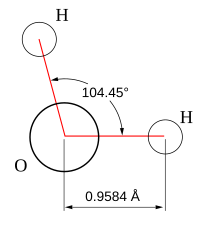
La geometría molecular se representa en una pirámide en la cual en la punta inicial hay una molécula de oxígeno con carga negativa, quedando en las otras dos puntas dos moléculas de hidrógeno con carga positiva, que son separadas por un ángulo de 104.5º; el enlace que une los hidrógenos con el oxígeno se llama enlace covalente, y también existe un enlace que une a otra pirámide idéntica a la anteriormente nombrada llamado enlace puente.
Tipos de estructura molecular
editar| Tipo de molécula | Forma | Disposición electrónica† | Angulación | Geometría‡ | Ejemplos |
|---|---|---|---|---|---|
| H | Molécula diatómica | = 180° | HF, O2, CO | ||
| AX2E0 | Lineal | = 180° | BeCl2, HgCl2, CO2, PbCl2 | ||
| AX2E1 | Angular | ≈ 120° | NO2−, SO2, O3 | ||
| AX2E2 | Angular forma "V" | ≈ 104,45º | H2O, OF2, SCl2 | ||
| AX2E3 | Lineal | = 180° | XeF2, I3− | ||
| AX3E0 | Trigonal plana | = 120° | BF3, CO32−, NO3−, SO3 | ||
| AX3E1 | Trigonal Piramidal | ≈107,3º | NH3, PCl3 | ||
| AX3E2 | Forma de T | = 90°,180° | ClF3, BrF3 | ||
| AX4E0 | Tetraédrica | ≈ 109,5º | CH4, PO43−, SO42−, ClO4− | ||
| AX4E1 | Balancín | = 90°, 120°, 180° | SF4 | ||
| AX4E2 | Cuadrada plana | = 90°, 180° | XeF4 | ||
| AX5E0 | Bipirámide trigonal | = 90°, 120°, 180° | PCl5 | ||
| AX5E1 | Pirámide cuadrangular | ≈ 90°, 180° | ClF5, BrF5 | ||
| AX6E0 | Octaédrica | = 90°, 180° | SF6 | ||
| AX6E1 | Pirámide pentagonal | = 72°, 90°, 180° | XeOF— 5, IOF2- 5[1] | ||
| AX7E0 | Bipirámide pentagonal | = 72°, 90°, 180° | IF7 |
Referencias
editar- ↑ Baran, E. (2000). «Mean amplitudes of vibration of the pentagonal pyramidal XeOF5− and IOF52− anions». Journal of Fluorine Chemistry 101: 61-63. doi:10.1016/S0022-1139(99)00194-3.
Bibliografía
editar- García González, Luis Ignacio (2008). «Cómo introducir la geometría molecular en 3º de la ESO». Anales de la Real Sociedad Española de Química 104 (1). ISSN=1575-3417 , pp. 47-49.
Enlaces externos
editar- Wikimedia Commons alberga una categoría multimedia sobre Geometría molecular.