Hantaviridae
Hantaviridae es una familia de virus que infectan animales. En mamíferos son transmitidos por roedores infectados (zoonosis). En humanos por lo general producen dos tipos de afecciones, un tipo de fiebre hemorrágica viral, la fiebre hemorrágica con síndrome renal (FHSR); y el síndrome pulmonar por hantavirus (SPHV), una afección muy grave.[1] Los Hantavirus son un grupo que pertenece al orden Bunyavirales, grupo C. Es considerado como un virus de riesgo de bioseguridad n.° 4.
| Hantavirus | ||
|---|---|---|
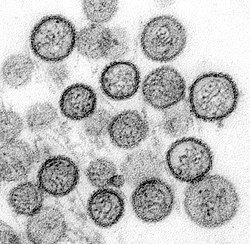 Imagen de microscopio electrónico de un tipo de Hantavirus | ||
| Taxonomía | ||
| Dominio: | Riboviria | |
| Reino: | Orthornavirae | |
| Filo: | Negarnaviricota | |
| Subfilo: | Polyploviricotina | |
| Clase: | Ellioviricetes | |
| Orden: | Bunyavirales | |
| Familia: | Hantaviridae | |
| Clasificación de Baltimore | ||
| Grupo: | V (Virus ARN monocatenario negativo) | |
El nombre Hantavirus proviene del río Hantan, al norte de las ciudades coreanas de Dongducheon y Paju, cerca de donde se aisló su miembro prototípico, el Virus Hantaan. En el decenio de 1930 se notificaron en Europa y Asia brotes de lo que se pensaba que era FHSR. Pero en 1978 se aisló el Hantaan y se confirmó que algunos roedores servían de reservorio de los virus que causaban la FHSR. Los virus Seoul, Dobrava y Puumala, son muy similares al Hantaan, se distribuyen en todo el territorio eurasiático y ocasionan FHSR.
Morfología
editarLos Hantavirus tienen forma oval a esférica (80-120 nm de diámetro). Son virus con envoltura que en su interior presentan una nucleocápside helicoidal.[1]
El genoma de los Hantavirus es muy particular, es de ARN monocatenario, circular y de polaridad negativa, dividido en tres segmentos de ARN de diferente longitud: S, M y L. El segmento S (del inglés Small: ‘pequeño’) codifica dos proteínas: la proteína N (proteína para la nucleocápside) y la NEP, una proteína no estructural (Non-Estructural Protein). El segmento M (Medium: ‘medio’) codifica para tres proteínas: G1, G2 y NEm (Non-Estructural molecule: «molécula no estructural»). El segmento L (Large: ‘grande’) está destinado para la ARN polimerasa.
Cada virión presenta tres nucleocápsides; cada nucleocápside está conformada por uno de los tres segmentos de ARN (S, M o L) y la proteína N. Serológicamente, la proteína N se usa para detectar las variantes específicas de virus.
La envoltura viral tiene su origen en la membrana plasmática de las células infectadas; presenta las proteínas G1 y G2 que protruyen la membrana e intervienen en la adherencia viral a las células diana.
Taxonomía
editarNomenclatura
editarEsta familia toma su denominación a partir los primeros casos en orillas del río Hantaan, en Corea; el virus responsable era el Virus Hantaan.
Es frecuente la confusión entre "Hantavirus" con "Virus Hantaan". Por un error de traducción, se hace entender al grupo biológico "Hantavirus" como "virus Hanta", cosa que no existe. Lo que si existe, es el "Virus Hantaan" (o HTNV en siglas), la especie tipo del género Hantavirus y la que le proporciona el nombre al grupo. Es común encontrar este tipo de error en la literatura castellana, muchas veces expresado con no concordancia de número, considerando "Hantavirus" como un sustantivo singular, o haciendo mención de un "virus Hanta" cuando corresponde la denominación genérica "Hantavirus". También, respetando las reglas de nomenclatura taxonómica, lo correcto es que este taxón esté presentado en itálica (que es lo usual).
Hantavirus
editarLa siguiente es una lista alfabética de especies de virus incluidas en la familia de Hantaviridae. Entre paréntesis constan las siglas usuales para la denominación viral.
- Virus Andes (ANDV)
- Virus Bayou (BAYV)
- Virus Black Creek Canal (BCCV)
- Virus Cano Delgadito (CADV)
- Virus Choclo (CHOV)
- Virus Dobrava-Belgrade (DOBV)
- Virus El Moro Canyon (ELMCV)
- Virus Hantaan (HTNV)
- Virus Isla Vista (ISLAV)
- Virus Khabarovsk (KHAV)
- Virus Laguna Negra (LANV)
- Virus Muleshoe (MULx)
- Virus New York (NYV)
- Virus Prospect Hill (PHV)
- Virus Puumala (PUUV)
- Virus Rio Mamore (RIOMV)
- Virus Rio Segundo (RIOSV)
- Virus Seoul (SEOV)
- Virus Sin Nombre (SNV)
- Virus Thailand (THAIV)
- Virus Thottapalayam (TPMV)
- Virus Topografov (TOPV)
- Virus Tula (TULV)
- Virus que infectan a la subfamilia Murinae
- Hantaan, HTN, Apodemus agrarius, Corea, Asia y Europa, FHSRb Sí
- Seoul SEO Rattus norvegicus, R. rattus, Corea Asia, Europa, América FHSR Sí
- Dobrava-Belgrade DOB Apodemus flavicollis, Eslovenia, Europa, Oriente Medio FHSR Sí
- Thai-749 THAI Bandicota indica, Tailandia, Asia, Se desconoce Sí
- Virus que infectan a la subfamilia Arvicolinae
- Puumala PUU Clethrionomys glareolus, Finlandia, Europa, Asia, FHSR Sí
- Prospect Hill PH Microtus pennsylvanicus, Maryland, América del Norte, Se desconoce Sí
- Tula TUL Microtus arvalis, Rusia, Europa, Se desconoce Sí
- Jabárovsk KBR Microtus fortis, Rusia, Asia, Se desconoce Sí
- Topografov TOP Lemmus sibiricus, Siberia Rusia, Asia, Se desconoce Sí
- Isla Vista ISLA Microtus californicus, California, América del Norte, Se desconoce No
- Virus que infectan a la subfamilia Sigmodontinae
- Sin Nombre SN Peromyscus maniculatus, Nuevo México, América del Norte, SPHc Sí
- New York NY Peromyscus leucopus, Nueva York, América del Norte, SPH Sí
- Black Creek Canal BCC Sigmodon hispidus, Florida, América, SPH Sí
- Bayou BAY Oryzomys palustris, Luisiana, Sudeste de los Estados Unidos, SPH Sí
- Caño Delgadito CANO Sigmodon alstoni, Venezuela, América del Sur, Se desconoce Sí
- Río Mamore RM Oligoryzomys microtis, Bolivia, América del Sur, Se desconoce Sí
- Laguna Negra CHP Calomys laucha, Paraguay, América del Sur, SPH Sí
- Muleshoe MULE Sigmodon hispidus, Texas, América, Se desconoce No
- El Moro Canyon ELMC Reithrodontomys megalotis, California, América del Norte, Se desconoce No
- Río Segundo RIOS Reithrodontomys mexicanus, Costa Rica, México, América Central, Se desconoce No
- Andes AND Oligoryzomys longicaudatus, Argentina, América del Sur, SPH Sí
- Virus que infectan a insectívoros
- Thottapalayam TPM Suncus murinus, India, Asia, Se desconoce Sí
Clínica y filogenia
editarEl análisis filogenético de los genes de los Hantavirus transmitidos por roedores ha indicado la existencia de tres linajes principales. Los virus que causan FHSR pertenecen a un linaje del Viejo Mundo, en tanto que los virus que causan SPHV comparten un linaje común del Nuevo Mundo y están en miembros de una sola subfamilia de roedores (Sigmodontinae) de la familia Muridae.
Algunos de los virus presentes en roedores sigmodontinos constituyen especies independientes, según pruebas genéticas, serológicas, vínculo con el huésped reservorio o los tres tipos de pruebas. Otros virus están en proceso de evaluación, como lo están los criterios para definir los Hantavirus spp.
En el continente americano se han identificado 13 Hantavirus spp. y de ellos, seis causan SPHV. Los anticuerpos séricos de pacientes de SPHV muestran reacción cruzada intensa con otros virus del Nuevo Mundo, pero en grado variable con los antígenos de Hantavirus spp. del Viejo Mundo.
Se reconocen dos grupos de Hantavirus spp. que se asocian a dos presentaciones clínicas diferentes: los Hantavirus del Viejo Mundo y los del Nuevo Mundo (Vignoli et al.).
Los Hantavirus del Viejo Mundo son predominantes en Asia (sobre todo en China y Corea) y Europa (Alemania, Francia, Bélgica, Holanda y Rusia); incluyen las especies Hantaan, Puumala, Seoul, Prospect Hill y Dobrava. Estos producen un cuadro conocido como fiebre hemorrágica con síndrome renal (FHSR) y son responsables de 100 000 casos anuales, presentando una mortalidad que oscila entre el 1 y 15% (Vignoli et al.).
Los Hantavirus del Nuevo Mundo predominan en toda América. Se identifican como productores de enfermedad febril asociada con insuficiencia respiratoria aguda, shock y una mortalidad del 60 a 80%; esta forma clínica se conoce como síndrome pulmonar por Hantavirus (SPHV).
Tras el brote en la región de Cuatro Esquinas (Four Corners, al sudoeste de EE. UU.) en 1993, fue identificado por primera vez un Hantavirus en el continente americano. Fue denominado "Virus Sin Nombre", "Convict Creek" o "Muerto Canyon", que hoy se conoce con el nombre de Four Corners (FC). Otro en el Nuevo Mundo es el Virus Andes, identificado en 1995, produjo la epidemia de SPHV en El Bolsón y Lago Puelo (Argentina) en 1996, aportando por primera vez evidencia epidemiológica de contagio persona a persona, ocasión en que fueron infectados varios médicos, algunos con desenlace fatal.
Infecciones por Hantavirus
editarLa infección por Hantavirus genera dos cuadros clínicos diferentes: la fiebre hemorrágica con síndrome renal (FHSR); y el síndrome pulmonar por hantavirus (SPHV).
El SPHV está producido por el Virus Sin Nombre, pero otros virus también están involucrados. Se han identificado cuatro Hantavirus como responsables de FHSR con síndrome renal:
- Virus Hantaan: transmitido por ratones de campo (Apodemus agrarius);
- Virus Seoul: transmitido por ratas (Rattus rattus y R. norvegicus);
- Virus Puumala: transmitido por varios roedores silvestres;
- Virus Dobrava: transmitido por otras especies de ratones de campo.
Hantavirus spp. son importantes en el ambiente de investigación clínico-científico, pues es común que estos virus se encuentren como contaminantes potenciales de materiales de laboratorio, de las muestras de animales para experimentación (se dispone de roedores) y sus derivados (anticuerpos monoclonales, cultivos celulares, etc).
Prevención
editarLa prevención más efectiva es eliminar o minimizar el contacto con roedores.[2]
Como el virus es transmitido por saliva, excreciones y mordeduras de roedores la protección en áreas comunes es clave para la prevención de la enfermedad.
Una prevención general se logra evitando lugares donde puedan alojarse y reproducirse roedores. Por eso es importante desechar nidos, sellar agujeros, colocar trampas vivas, limpiar y desinfectar con frecuencia, evitar dejar alimento de fácil acceso para roedores (migas, comida en el suelo, etc.).[3]
Es importante tener consideraciones particulares en industrias u hogares en zonas rurales, así como personas en riesgo como menores o adultos mayores (jardines, escuelas, geriátricos, etc). En caso de visualizar roedores se debe comunicar a entes gubernamentales de control de plagas como áreas de zoonosis, es común que los Estados tengan áreas específicas. A su vez existen diversas guías para diversos sectores que permiten que la ciudadanía adopte medidas para la reducción de los riesgos, tal es el caso del Manual para el Control Integral de Roedores (Colombia)[4] y el Manual para el control de roedores en el ámbito domiciliario (INTA).[5]
Tratamiento
editarDado que las opciones de tratamiento son limitadas, la mejor protección es evitar los roedores y sus hábitats.
Científicos de la Universidad de Concepción (Chile), liderados por María Inés Barría, descubrieron el primer tratamiento específico, con base en anticuerpos monoclonales. El proceso comenzó con detectar por qué algunos pacientes sobrevivían al virus y se encontró que tenían una gran cantidad de anticuerpos neutralizantes.[6]
En Chile, según protocolos del Ministerio de Salud, un paciente con infección por Hantavirus suele ser intubado, sometido a ventilación mecánica y, si comienzan a deteriorarse sus signos vitales, suele aplicársele un protocolo de oxigenación por membrana extracorpórea (ECMO), tratamiento que implica oxigenar la sangre fuera del cuerpo y luego reintroducirla.
Otra indicación autorizada por el Minsal desde 2016 es la transfusión de plasma convalesciente, es decir, plasma inmune de pacientes que sobrevivieron a la infección y que se presume han desarrollado anticuerpos.
Epidemiología
editarAmérica del Norte
editarCanadá
editarLa causa principal de la enfermedad en Canadá son los ratones ciervos infectados con el virus Sin Nombre. Entre 1989 y 2014, hubo un total de 109 casos confirmados, con una tasa de mortalidad estimada del 29%. El virus existe en ratones ciervos en todo el país, pero los casos se concentraron en el oeste de Canadá (Columbia Británica, Alberta, Saskatchewan y Manitoba) con solo un caso en el este de Canadá. En Canadá "[todos] los casos ocurrieron en entornos rurales y aproximadamente el 70% de los casos se han asociado con actividades domésticas y agrícolas".
Estados Unidos
editarEn los Estados Unidos, los casos menores de SPH incluyen el ortohantavirus Sin nombre, el ortohantavirus de Nueva York, el ortohantavirus Bayou y posiblemente el ortohantavirus del Canal Black Creek.
Hasta enero de 2017, se habían notificado 728 casos de hantavirus en los Estados Unidos acumulativamente desde 1995, en 36 estados, sin incluir los casos con presunta exposición fuera de los Estados Unidos. Más del 96% de los casos han ocurrido en estados al oeste del río Misisipi. Los 10 estados principales por número de casos reportados (que difiere ligeramente de un recuento ordenado por el estado de exposición original) fueron Nuevo México (109), Colorado (104), Arizona (78), California (61), Washington (50) , Texas (45), Montana (43), Utah (38), Idaho (21) y Oregón (21); El 36% del total de casos reportados han resultado en muerte.
América del Sur
editarLos agentes de HPS que se encuentran en América del Sur incluyen el virus de los Andes (también llamado Orán, Castelo de Sonhos, portugués para «Castillo de sueños», Lechiguanas, Juquitiba, Araraquara y Bermejo, entre muchos otros sinónimos), que es el único hantavirus que ha mostrado una forma de transmisión interpersonal y el virus Laguna Negra, un pariente extremadamente cercano del virus Río Mamore previamente conocido.
Los roedores que han demostrado portar hantavirus incluyen Abrothrix longipilis y Oligoryzomys longicaudatus.
Asia
editarEn China, Hong Kong, la península de Corea y Rusia, la fiebre hemorrágica con síndrome renal es causada por los virus Hantaan, Puumala y Seúl.
China
editarEn marzo de 2020, un hombre de Yunnan dio positivo por Hantavirus. Murió mientras viajaba a Shandong para trabajar en un autobús alquilado. Según los informes de Global Times, alrededor de otras 32 personas han sido analizadas para detectar el virus.
Europa
editarEn Europa, se sabe de dos hantavirus, los virus Puumala y Dobrava-Belgrado, causan fiebre hemorrágica con síndrome renal. Puumala generalmente causa una enfermedad generalmente leve, nefropatía epidémica, que generalmente se presenta con fiebre, dolor de cabeza, síntomas gastrointestinales, insuficiencia renal y visión borrosa. Las infecciones de Dobrava son similares, excepto que a menudo también tienen complicaciones hemorrágicas.
El virus de Puumala es portado por su huésped roedor, el ratón de campo (Clethrionomys glareolus), y está presente en la mayor parte de Europa, excepto en la región mediterránea. Hay cuatro genotipos conocidos del virus Dobrava, cada uno de ellos portado por una especie de roedor diferente. El genotipo Dobrava se encuentra en el ratón de cuello amarillo (Apodemus flavicollis); genotipos Saaremaa y Kurkino en el ratón de campo rayado (Apodemus agrarius) y genotipo Sochi en el ratón de campo del Mar Negro (Apodemus ponticus).
Solo en 2017, el Instituto Robert Koch (RKI) en Alemania recibió 1.713 notificaciones de infecciones por hantavirus
Bibliografía
editar- Organización Panamericana de la Salud (OPS): Hantavirus en las Américas: guía para el diagnóstico, el tratamiento, la prevención y el control. desarrollado por el Grupo Especial para el Estudio de Hantavirus, marzo de 1998, Georgia, EE. UU.
- Trilla García A & Alonso Fernández PL: Infecciones causadas por arbovirua y arenavirus: viriasis transmitidas por artrópodos y roedores, en Farreras Valentí P & Rozman C: Medicina Interna, (2)330:2857-2864, 14ª Harcourt, Madrid, 2000.
- Vignoli R, Calvelo E, Chiparelli H, Schelotto F: Virosis Emergentes de Importancia Regional: Virus Hanta, Dep.Bact.Vir., Fac.Med., Montevideo, Uruguay.
Referencias
editar- ↑ a b «Hantaviridae ~ ViralZone page». viralzone.expasy.org. Consultado el 25 de marzo de 2020.
- ↑ «Hantavirus Prevention». CDC. USA.gov.
- ↑ «Hantavirus: Canadian Lung Association». Canadian Lung Association. 26 de noviembre de 2015. Archivado desde el original el 2 de marzo de 2011. Consultado el 23 de abril de 2018.
- ↑ Manual para el Control Integral de Roedores Archivado el 12 de enero de 2019 en Wayback Machine., Ministerio de Salud, Gobierno de Colombia
- ↑ Manual para el control de roedores en el ámbito domiciliario, INTA, Argentina
- ↑ Sur, A. D. N. (10 de enero de 2019). «Investigadora chilena desarrolló un tratamiento para curar el hantavirus». ADN Sur | Agencia de noticias - Comodoro Rivadavia - Chubut. Archivado desde el original el 11 de enero de 2019. Consultado el 11 de enero de 2019.
Véase también
editar- Infecciones por Hantavirus
- Bunyavirus
- Filovirus
- Infecciones por Arenavirus
- Fiebres hemorrágicas sudamericanas
- Infecciones por Arbovirus