Hexametilfosforamida
La hexametilfosforamida, frecuentemente abreviada HMPA, es un compuesto organofosforado que tiene la fórmula [(CH3)2N]3PO. Este líquido incoloro es un solvente aprótico polar muy útil, y un aditivo en síntesis orgánica.
| Hexametilfosforamida | ||
|---|---|---|
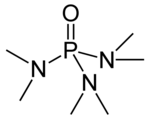 Estructura química | ||
 | ||
| Nombre IUPAC | ||
| Hexametilfosforamida | ||
| General | ||
| Fórmula molecular | C6H18N3OP | |
| Identificadores | ||
| Número CAS | 680-31-9[1] | |
| Número RTECS | TD0875000 | |
| ChEBI | 24565 | |
| ChEMBL | CHEMBL3187047 | |
| ChemSpider | 12158 | |
| PubChem | 12679 | |
| UNII | M42TU5843Z | |
| KEGG | C19250 | |
| Propiedades físicas | ||
| Masa molar | 17 920 g/mol | |
| Punto de fusión | 280,4 K (7 °C) | |
| Punto de ebullición | 508 K (235 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura y reactividad
editarHMPA es el óxido de la fosfina terciaria altamente básica hexametilfosforotriamida (HMPT), P(NMe2)3. Como otros óxidos de fosfina (por ejemplo, el óxido de trifenilfosfina), la molécula tiene un núcleo tetraédrico y un enlace P-O que está altamente polarizado, con una significativa carga negativa residiendo en el átomo de oxígeno.
Los compuestos que contienen un enlace nitrógeno-fósforo típicamente son degradados por el ácido clorhídrico para formar una amina protonada y fosfato.
Aplicaciones
editarHMPA es usado como solvente para polímeros, gases, y compuestos organometálicos. Mejora la selectividad de las reacciones de litiación, porque rompe los oligómeros de bases de litio, tales como el butillitio. Debido a que el HMPA solvata a los cationes, a la vez que no solvata aniones, acelera algunas reacciones SN2 difíciles. El átomo básico de oxígeno en HMPA se coordina fuertemente a Li+.[2] Un complejo de peróxido de molibdeno del HMPA es usado como oxidante en síntesis orgánica.
Reactivos alternativos
editarEl dimetilsulfóxido puede ser usado frecuentemente en vez del HMPA como solvente. Ambos son fuertes aceptores de enlace de hidrógeno, y sus átomos de oxígeno se unen a cationes metálicos. Otras alternativas al HMPA incluyen la tetraalquilureas[3] y las alquilureas cíclicas como DMPU(N,N'-dimetilpropilenourea).[4]
Toxicidad
editarHMPA es solo moderadamente tóxico, pero ha mostrado causar cáncer nasal en ratas.[2] HMPA puede ser degradado a compuestos menos tóxicos por acción del ácido clorhídrico.
Referencias
editar- ↑ Número CAS
- ↑ a b Dykstra, R. R. "Hexamethylphosphoric Triamide" Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons. doi 10.1002/047084289X.rh020
- ↑ Beck, A. K.; Seebach, D. "N,N'-Dimethylpropyleneurea" in Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, New York. doi 10.1002/047084289X.rd366.
- ↑ Triptikumar Mukhopadhyay, Dieter Seebach (1982). «Substitution of HMPT by the cyclic urea DMPU as a cosolvent for highly reactive nucleophiles and bases». Helvetica Chimica Acta 65 (1): 385-391. doi:10.1002/hlca.19820650141.
Enlaces externos
editar- The substance profile of HMPA in the report on carcinogens
- Merck Index, 12th Edition, 4761.