MOG glicoproteína de mielina del oligodendrocito
La glicoproteína de oligodendrocito asociada a mielina (MOG) también glicoproteína de la mielina de los oligodendrocitos es una glucoproteína expresada exclusivamente en el sistema nervioso central (SNC), específicamente en la superficie de las vainas de mielina de los oligodendrocitos.[1] Se cree que es importante en la mielinización de los nervios del SNC. En los humanos, esta proteína está codificada por el gen MOG.[2]
| Glicoproteína de oligodendrocito asociada a mielina MOG | ||||
|---|---|---|---|---|
 | ||||
| Estructuras disponibles | ||||
| PDB | Buscar ortólogos: | |||
| Identificadores | ||||
| Nomenclatura |
Otros nombres Myelin-oligodendrocyte glycoprotein
| |||
| Símbolo | MOG (HGNC: 7197) | |||
| Identificadores externos | ||||
| Locus | Cr. 6 p22.1 | |||
| Estructura/Función proteica | ||||
| Tamaño | 252 (aminoácidos) | |||
| Peso molecular | 26.000-28.633 (Da) | |||
| Funciones |
Componente menor de la vaina de mielina. Terminación y mantenimiento de la vaina de mielina. Comunicación entre células. | |||
| Dominio proteico |
Inmunoglobulina V símil Transmembrana Bucle intracelular | |||
| Motivos |
Hélice alfa (6%) en tres segmentos helicoidales cortos Lámina beta (43%) en diez láminas beta. | |||
| UniProt |
| |||
Se especula que sirve como una molécula de adhesión que hace falta para proporcionar integridad estructural a la vaina de mielina. Teniendo en cuenta su estructura molecular y su dominio inmunoglobulina extracelular, se ha propuesto esta proteína como un receptor de superficie celular.
En los últimos años MOG ha ganado relevancia clínica importante ya que se le ha identificado como un autoantígeno en diversas enfermedades desmielinizantes del SNC.[3]
Funciones y rol inmunológico de la MOG
editarAún no se ha podido concretar la función de la proteína MOG, pero se ha visto que su expresión en las membranas de los oligodendrocitos y en la capa superficial de la vaina de mielina es clave para las diversas competencias que esta ejerce en el sistema nervioso central.[2]
Una de las posibles funciones que realiza MOG es mantener la integridad de las proteínas que forman parte de la vaina de mielina, debido a sus funciones estructurales o de señalización. Se ha observado que MOG actúa como una molécula adhesiva celular, que ayuda a mantener la integridad de la vaina de mielina. También MOG es un marcador para la maduración de los oligodendrocitos, esto se debe a que la glicoproteína tiene una manifestación tardía en el desarrollo postnatal.
MOG desempeña respuestas inmunitarias humorales y mediadas por células que se convierten en una diana potencial en las enfermedades inflamatorias desmielinizantes, como la esclerosis múltiple, cuando nuestro organismo crea anticuerpos contra la molécula MOG. La función de adhesión de la proteína MOG tiene un papel clave en las respuestas inmunitarias ya que convierte a la proteína en un blanco (antígeno) de anticuerpos y respuestas inmunes.[4]
Otra función de la proteína MOG que plantean estudios recientes es su involucramiento en la regulación de la estabilidad de los microtúbulos dentro de los oligodendrocitos. Esta afirmación es respaldada por una serie de alteraciones que se han observado en la organización del citoesqueleto en células que expresan MOG.[2][5]
MOG también podría tener una función como mediador de interacciones entre la mielina y el sistema inmunológico ya que se puede unir a la proteína C1q, esto indica que posiblemente influye en la activación y modulación de la vía clásica del complemento, que es un componente indispensable de la respuesta de la inmunidad innata. Esta función plantea que la proteína MOG podría ayudar al equilibrio entre la activación y la inhibición de la respuesta inmune, convirtiendo a MOG en un potencial regulador de procesos inflamatorios en enfermedades autoinmunes o neuroinflamatorias.[6]
Además se ha propuesto una relación directa entre las regiones asociadas a la membrana de MOG y el glicolípido galactocerebrósido (Gal-C). Esta hipótesis propone que los anticuerpos contra MOG y contra Gal-C activan la misma vía de señalización, y esto conduce a la degradación de la proteína básica de mielina (MBP). Esta interacción es importante ya que podría influenciar en la topología de la membrana y la función de ambas moléculas.[7]
Aunque todas estas posibles funciones de MOG están basadas en estudios científicos, la función exacta de la proteína aún es un tema de investigación activa y hacen falta más estudios para afirmar con certeza las hipótesis planteadas.
Estructura y Topología
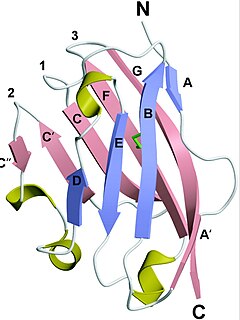
editarInvestigadores noruegos pudieron determinar en ratas, la estructura extracelular de la proteína MOG, mediante cristalografía de rayos X a una resolución 1,45 Å.[8]
La glicoproteína de la mielina de los oligodendrocitos (MOG) presenta una topología proteica distintiva que comienza con un segmento extracelular similar al dominio de inmunoglobulina V (IgV), el cual participa en funciones de adhesión y reconocimiento en el sistema inmune.
La estructura incluye un dominio transmembrana (TM) hidrofóbico que atraviesa la membrana plasmática, facilitando su anclaje y estabilidad.
Seguido se encuentra un bucle citoplasmático, este, actúa como un puente entre las regiones estructurales. Esta estructura avanza por una segunda región hidrofóbica que se asocia estrechamente con la membrana, contribuyendo a la orientación de la proteína y a su interacción con componentes lipídicos. Finalmente, la topología de la MOG acaba con una cola citoplasmática que desempeña roles en señalización intracelular y posiblemente en interacciones con otras proteínas.[9][10]
Estructura primaria: tiene una longitud de 245-252 aminoácidos y un peso molecular de 26-28 kDa.[11] La secuencia de aminoácidos de MOG está altamente conservada entre las especies animales (>90%), lo que indica una función biológica importante.[12]
Estructura secundaria: analizada mediante el método DSSP presenta un 6% de contenido helicoidal (hélice alfa) y un 43% de lámina beta, con tres segmentos helicoidales cortos y diez láminas beta.[13]
Estructura terciaria: estas láminas beta están organizadas en dos láminas beta antiparalelas que adoptan una conformación en forma de sándwich, similar a la estructura de una inmunoglobulina, esto le proporciona estabilidad y es compatible con sus roles en la compactación y función de la mielina.[13]
La proteína MOG también tiene tres "lazos" en su extremo más alejado de la membrana, llamados Lazos 1, 2 y 3. Estos lazos están en una posición similar a las "regiones de unión" de algunas proteínas inmunes y forman una superficie plana sin mucha carga, con un aminoácido (His-103) que sobresale.[6] También presenta una "franja importante" de carga electronegativa que se extiende desde el extremo N-terminal y recorre aproximadamente la mitad de la longitud de la molécula, esto tiene implicaciones importantes como su función para el reconocimiento molecular, la estabilidad de la estructura de mielina, su interacción con otras moléculas y células, etc.[13]
Gen
editarEl gen MOG se ubica en el cromosoma 6, en su brazo corto p, concretamente en la banda 22 y la sub-banda 1; utilizando la sintaxis del locus, de manera resumida: 6p22.1.
Evolución y Homología
editarLa evolución de esta glucoproteína destaca por la importancia que tiene MOG en el SNC de los mamíferos. Además, sugiere que ha sido favorecida por la selección natural debido a su papel esencial en la mielinización y posiblemente en otras funciones neuronales.
La MOG se ha conservado evolutivamente entre los mamíferos. Esta conservación se debe a que tiene una alta homología en su región codificante de DNA en especies como humanos, ratas, ratones y bovinos. Es decir, las secuencias de DNA que codifican para esta proteína son muy similares entre estas especies, y por lo tanto, esta homología implica que las secuencias tienen una serie de nucleótidos en común y algunos en la misma posición.[14]
El gen MOG en humanos puede generar múltiples variantes de la proteína a través del empalme alternativo (splicing). Esto quiere decir que un mismo gen es capaz de codificar diferentes formas de esta proteína MOG, cada una con características únicas. En los humanos se han descubierto varias isoformas de MOG, lo que lleva a pensar que estas variantes podrían tener funciones distintas en el sistema nervioso central.[15][16]
MOG es una proteína altamente conservada evolutivamente debido a su participación en funciones esenciales, es por esto que su estructura que ha sufrido pocos cambios a lo largo del tiempo. Cuando se producen mutaciones en regiones críticas de la MOG, sobre todo en el dominio que interactúa con otras moléculas, habría efectos negativos en la estructura e integridad de la mielina. La mielina es esencial para transmitir las señales nerviosas correctamente y por ello, si hay alteraciones en MOG podría haber graves consecuencias en el funcionamiento del sistema nervioso. Es por esto, que se sugiere un importante papel biológico para esta proteína.[17][18]
Localización genómica y Estructura del gen MOG
editarEl gen MOG humano y de las ratas está ubicado en diferentes cromosomas. El gen MOG humano se encuentra en el cromosoma 6 (humano) dentro del locus del gen del antígeno leucocitario humano (HLA). En cambio, el gen MOG del ratón se ubica en el cromosoma 17. Aunque tienen ciertas diferencias estructurales y de secuencia, estos tienen funciones similares.[19][16] Estas, son unas regiones del genoma fundamentales para el sistema inmunitario porque codifican múltiples moléculas clave en el procesamiento y la presentación de antígenos en la superficie celular.[9] En los humanos, estos antígenos son reconocidos por las células T, activando así respuestas inmunológicas específicas.[20]
Estructura del gen:
El gen MOG abarca un transcrito nuclear primario de 15.561 nucleótidos, desde el inicio de la transcripción hasta el sitio de poliadenilación (cola poli (A)). La estructura genética del gen está compuesta por 8 exones y 7 intrones.
Los intrones varían en tamaño de 242 a 6.484 pares de bases y contienen numerosos elementos de ADN repetitivos, específicamente 14 secuencias Alu dentro de tres de los intrones y un elemento Alu adicional en la región no traducida 3′.
Las secuencias Alu se clasifican en función de su subfamilia, lo cual sugiere una conservación evolutiva y posibles roles funcionales en la regulación o evolución del gen.
Secuenciación de regiones específicas del gen MOG:
- Se secuenciaron 763 nucleótidos en la región 5', que se encuentra antes del inicio de la transcripción del gen.
- También se analizaron 1214 nucleótidos en la región 3', que sigue al sitio donde se añade la cola de poli(A) (una secuencia importante para estabilizar el ARN mensajero).
Identificación de secuencias clave para la transcripción: En la región 5' (antes del gen), se encontraron varias "secuencias de consenso". Estas secuencias son sitios específicos que ayudan a regular la transcripción, y algunos son comunes en otros genes de mielina. Esto sugiere que podrían tener un rol importante en la activación del gen MOG.
Detección de variaciones genéticas (polimorfismos): Se identificaron dos tipos de repeticiones en el gen (dinucleótidos CA y tetranucleótidos TAAA). Estas variaciones podrían ser útiles como marcadores genéticos en estudios para analizar la relación del gen MOG con ciertas enfermedades o su herencia en familias.[12]
Localización subcelular
editarEn humanos, el ARNm derivado del gen que codifica la glicoproteína de oligodendrocito de mielina (MOG) experimenta un proceso de empalme alternativo que produce más de 9 isoformas proteicas diferentes. En un estudio se analizó la localización subcelular y el tráfico en la membrana de seis de estas isoformas. Se observó que dos de ellas, específicamente las isoformas 25.6 y 25.1, se expresan en la superficie celular. Por otro lado, tres isoformas, concretamente las 22.7, 21.0 y 20.5, presentan una distribución intracelular, localizándose en el retículo endoplásmico y/o en los endosomas. Finalmente, la isoforma 16.3 carece de un dominio transmembrana y es secretada. Es importante destacar que un cambio en la localización de las isoformas puede afectar sus interacciones con otras moléculas y, por lo tanto, su función.[9]
La Enfermedad asociada a anticuerpos MOG
editarLos avances que se han producido en las pruebas para la detección de anticuerpos MOG, han permitido a los médicos distinguir la enfermedad asociada con anticuerpos MOG de la neuromielitis óptica y la esclerosis múltiple.
Actualmente la enfermedad de anticuerpos MOG se considera una entidad diagnóstica independiente[21] y para poder llevar a cabo el diagnóstico se utilizan estudios sanguíneos e imagenológicos.[22]
La enfermedad de anticuerpos MOG es una enfermedad autoinmune inflamatoria del sistema nervioso central caracterizada por una disfunción inmunológica de dicha proteína, que se encuentra en la capa más externa que rodea la médula espinal, el cerebro y los nervios ópticos.[21][23]
Este tipo de anticuerpos se han identificado en pacientes pédiatricos con patologías desmilielinizantes, como por ejemplo la encefalitis aguda diseminada. En cambio, en la población adulta los anticuerpos MOG se han encontrado en personas que padecen síndromes neuroinflamatorios como por ejemplo mielitis, neuritis óptica, síndromes de tallo cerebral, lesiones de los núcleos basales y encefalitis cortical focal.
Fenotipos de la enfermedad asociada a anticuerpos MOG
editarLa enfermedad asociada a anticuerpos MOG presenta diversos fenotipos, siendo los más frecuentes la neuritis óptica, la mielitis transversa y la encefalomielitis aguda diseminada.[24]
Neuritis óptica
editarLa neuritis óptica con presencia de anticuerpos MOG positivos, es el fenotipo de presentación más frecuente. La manifestación más común de esta patología es el dolor ocular tanto de un ojo (unilateral) como de los dos (bilateral).[25]
En este síndrome, se produce una inflamación del nervio óptico, y la MOG juega un papel de desmielinización entre éste y el tracto óptico. Concretamente se ve afectado el segmento anterior del nervio óptico, éste se estrecha, se torna edematoso y tiene extensión de la inflamación.
El tratamiento inicial de esta patología mejora principalmente el campo de visión central. Sin embargo, puede persistir un déficit en la visión periférica que suele mejorar gradualmente a medida que la vaina de mielina que ha sido dañada se regenera.[25]
Cabe destacar, que a diferencia de los otros fenotipos de esta enfermedad, hay un 70-80% de probabilidad de recaída.[26][22] lo que puede conllevar a un daño axonal y a déficits residuales permanentes. De hecho la alta recurrencia o recaída del cuadro es un aspecto clave para diagnosticar la neuritis óptica asociada a anticuerpos MOG.[24]
Mielitis transversa
editarLa mielitis transversa representa el segundo fenotipo más común de la enfermedad, representando así el 3-4% de los casos.[27] Normalmente se manifiesta como mielitis longitudinalemte extensa, caracterizada por la afectación de 3 o más segmentos verterbales adyacentes. Cuando este síndrome está asociado a anticuerpos MOG, también se ve afectada la parte baja de la médula espinal dorsal y el cono medular. Consecuentemente, presenta disfunciónes severas intestinales, vesicales y érectiles.[25] Cabe destacar también que otros hallazgos frecuentes son la atrofia medular[28] y lesiones del canal ependimario.[29][30]
La gran mayora de pacientes que la padecen logran recueprar su funcionalidad y solo el 5% presenta secuelas graves.[24]
Encefalomielitis aguda diseminada
editarLa encefalomielitis aguda diseminada es una enfermedad autoinmune caracterizada por la pérdida de mielina y déficit multifocal neurológico.[25] Se considera como uno de los fenotipos más frecuentes de la enfermedad asociada a anticuerpos anti-MOG, especialmente en pacientes pediátricos y el curso de la patología en el 80% de los casos es monofásico (no hay recaída).[31]
Existen estudios específicos sobre la enfermedad asociada a anticuerpos anti-MOG focalizado en niños. El estudio publicado por Armangue en el que incluyó 239 niños de entre 3,7 y 10 años que padecian enfermedades desmielinizantes del sistema nervioso central, 94 dieron positivo en anticuerpos anti-MOG y el 65% de ellos presentaba encefalomielitis aguda diseminada.[32][24]
Véase también
editarReferencias
editar- ↑ Pham-Dinh, Danielle; Dellagaspera, Bruno; Kerleroderosbo, Nicole; Dautigny, André (1995). «Structure of the Human Myelin/Oligodendrocyte Glycoprotein Gene and Multiple Alternative Spliced Isoforms». Genomics (en inglés) 29 (2): 345-352. doi:10.1006/geno.1995.9995. Consultado el 4 de noviembre de 2024. (requiere suscripción).
- ↑ a b c Pham-Dinh, Danielle; Jones, Elsy P.; Pitiot, Gilles; Della Gaspera, Bruno; Daubas, Philippe; Mallet, Jacques; Le Paslier, Denis; Fischer Lindahl, Kirsten et al. (1995). «Physical mapping of the human and mouse MOG gene at the distal end of the MHC class Ib region». Immunogenetics (en inglés) 42 (5): 386-391. ISSN 0093-7711. doi:10.1007/BF00179400. Consultado el 4 de noviembre de 2024. (requiere suscripción).
- ↑ Zhong, Xiaonan; Wang, Yina; Luo, Wenjing; Ma, Xiaoyu; Sun, Xiaobo; Jiang, Boxiong; Qiu, Wei (15 de abril de 2023). «Evolution in anti-myelin oligodendrocyte glycoprotein antibody detection and its clinical significance: a narrative review». Annals of Translational Medicine (en inglés) 11 (7): 287-287. ISSN 2305-5847. doi:10.21037/atm-20-4547. Consultado el 15 de noviembre de 2024.
- ↑ «PROTEIN FUNCTION». Protein Atlas.
- ↑ Johns T.G.; Bernard C.C. (1999). «The structure and function of myelin oligodendrocyte glycoprotein» [La estructura cristalina de la glicoproteína de mielina de los oligodendrocito, un autoantígeno clave en la esclerosis múltiple]. Review J Neurochem (en inglés) 72 (1): 1-9. doi:10.1046/j.1471-4159.1999.0720001.x.
- ↑ a b Clements, Craig S. (2003). «The crystal structure of myelin oligodendrocyte glycoprotein, a key autoantigen in multiple sclerosis». PNAS: Proc Natl Acad Sci U.S.A. (en inglés) 100 (19): 11059-11064. PMC 196926. PMID 12960396.
- ↑ von Büdingen, H.-Christian; Mei, Feng; Greenfield, Ariele; Jahn, Sarah; Shen, Yun-An A.; Reid, Hugh H.; McKemy, David D.; Chan, Jonah R. (14 de septiembre de 2015). «The myelin oligodendrocyte glycoprotein directly binds nerve growth factor to modulate central axon circuitry». Journal of Cell Biology (en inglés) 210 (6): 891-898. ISSN 0021-9525. doi:10.1083/jcb.201504106. Consultado el 15 de noviembre de 2024.
- ↑ Breithaupt, Constanze; Schubart, Anna; Zander, Hilke; Skerra, Arne; Huber, Robert; Linington, Christopher; Jacob, Uwe (2003). «Structural insights into the antigenicity of myelin oligodendrocyte glycoprotein». PNAS Proceedings of the National Academy of Sciences (en inglés) 100 (16): 9446-9451. ISSN 0027-8424. PMC 170938. PMID 12874380. doi:10.1073/pnas.1133443100. Consultado el 12 de noviembre de 2024.
- ↑ a b c Boyle, Louise H.; Traherne, James A.; Plotnek, Gemma;; Ward,Rosemary; Trowsdale, John (2007). «Splice variation in the cytoplasmic domains of myelin oligodendrocyte glycoprotein affects its cellular localisation and transport». J Neurochem (en inglés) 102 (6): 1853-1862. PMC 2156149. PMID 17573820. doi:10.1111/j.1471-4159.2007.04687.x.
- ↑ «Gen MOG - Glicoproteína de oligodendrocitos de mielina». Genecards.
- ↑ «Q5SSB8_HUMAN». UniProt.
- ↑ a b Roth, Marie-Paule; Malfroy, Laurence; Offer, Claudie; Sevin, Jacqueline; Enault, Geneviève; Borot, Nicolas; Pontarotti, Pierre; Coppin, Hélène (1995). «The Human Myelin Oligodendrocyte Glycoprotein (MOG) Gene: Complete Nucleotide Sequence and Structural Characterization». Genomics (en inglés) 28 (2). pp. 241-250. PMID 8530032. doi:10.1006/geno.1995.1137. Consultado el 4 de noviembre de 2024. (requiere suscripción).
- ↑ a b c «Glicoproteína de oligodendrocitos de mielina». Academia-lab. Enciclopedia. Consultado el 18 de noviembre de 2024.
- ↑ Gómez Sánchez, José Antonio (2010). IMPLICACIÓN DE LA VÍA NRG-ErbB EN LA MIELINIZACIÓN DEL SISTEMA NERVIOSO PERIFÉRICO (SNP), LA NEUROFIBROMATOSIS Y EL DESARROLLO DE TUMORES MALIGNOS DEL SNP. (Tesis). Dialnet. Instituto de Neurociencias. Consultado el 12/11/2024.
- ↑ Allamargot, Chantal; Gardinier, Minnetta V. (2007). «Alternative isoforms of myelin/oligodendrocyte glycoprotein with variable cytoplasmic domains are expressed in human brain». Journal of Neurochemistry (en inglés.) 101 (2): 298-312. ISSN 0022-3042. PMID 17402967. doi:10.1111/j.1471-4159.2006.04296.x. Consultado el 15 de noviembre de 2024.
- ↑ a b Peschl, Patrick; Bradl, Monika; Höftberger, Romana; Berger, Thomas; Reindl, Markus (2017). «Myelin Oligodendrocyte Glycoprotein: Deciphering a Target in Inflammatory Demyelinating Diseases [Glicoproteína de oligodendrocitos de mielina: descifrando un objetivo en las enfermedades inflamatorias desmielinizantes]». Frontiers in Immunology, Front Immunol. (REVISIÓN) (en inglés) 8: 529. PMC 5420591. PMID 28533781. doi:10.3389/fimmu.2017.00529. Consultado el 11 de noviembre de 2024.
- ↑ Konaté, Mariam M.; Plata, Germán; Park, Jimin; Usmanova, Dinara R.; Wang, Harris; Vitkup, Dennis (18 de septiembre de 2019). «Molecular function limits divergent protein evolution on planetary timescales». En Ben-Tal, Nir, ed. eLife 8: e39705. ISSN 2050-084X. doi:10.7554/eLife.39705. Consultado el 15 de noviembre de 2024.
- ↑ Malhis, Nawar; Jones, Steven J.M.; Gsponer, Jörg (5 de abril de 2019). «Improved measures for evolutionary conservation that exploit taxonomy distances». Nature Communications (en inglés) 10 (1): 1556. ISSN 2041-1723. doi:10.1038/s41467-019-09583-2. Consultado el 15 de noviembre de 2024.
- ↑ Murphy, Kenneth; Weaver, Casey (1 de marzo de 2016). Janeway's Immunobiology. Consultado el 10 de noviembre de 2024.
- ↑ Janeway, C.A.;; Travers, P.; Walport, M.; Shlomchik M.J. (2001). Immunobiology: The Immune System in Health and Disease (5.a edición). New York: Garland Science.
- ↑ a b «Sobre la Enfermedad de Anticuerpo MOG (Mielina Oligodendrocito Glicoproteína)». Mass General Hospital.
- ↑ a b Hervás-García, J.V.;; Pagani-Cassara F. (2019). «Neuropatía óptica inflamatoria recurrente crónica: revisión de la bibliografía». Revista de Neurol 68. pp. 524-530.
- ↑ Cárdenas-Robledo, Simón; Arenas-Vargas, Laura Estefanía; Guerrero-Gómez, Diego Armando; Carvajal-Junco, René; Guío-Sánchez, Claudia (2023). «Enfermedad asociada a anticuerpos contra la glicoproteína de mielina de oligodendrocitos». Acta Neurol Colomb. (Bogotá: SciELO) 39 (4).
- ↑ a b c d Jurynczyk M.; Jacob A, Fujihara K.; Palace J. «Myelin oligodendrocyte glycoprotein (MOG) antibody-associated disease: practical considerations». Practical Neurology 19 (3): 187-195. (requiere suscripción).
- ↑ a b c d Ricaurte-Fajardo A.; Zarco L.A. (2020). «Características clínicas del espectro de la enfermedad asociada a los anticuerpos contra la glucoproteína del oligodendrocito asociada a la mielina» (PDF). Revista de Neurología (REVISIÓN) 71 (7). pp. 257-269.
- ↑ Kezuka T.; Ishikawa H. (2018). «Diagnosis and treatment of anti-myelin oligodendrocyte glycoprotein antibody positive optic neuritis». Jpn J Ophthalmol 62 (2): 101-108. (requiere suscripción).
- ↑ Jarius S. (2016). «MOG-IgG in NMO and related disorders: a multicenter study of 50 patients. Part 2: epidemiology, clinical presentation, radiological and laboratory features, treatment responses, and long-term outcome». J Neuroinflammation 13 (1). p. 280.
- ↑ Chien C, Scheel M, Schmitz-Hübsch T, Borisow N, Ruprecht K, Bellmann-Strobl J.; Friedemann Paul, Alexander U Brandt (2019). «Spinal cord lesions and atrophy in NMOSD with AQP4-IgG and MOG-IgG associated autoimmunity». Mult Scler 25 (14): 1926-1936. (requiere suscripción).
- ↑ Denève M., Biotti D., Patsoura S., Ferrier M., Meluchova Z., Mahieu L. (2019). «MRI features of demyelinating disease associated with anti-MOG antibodies in adults». Journal of Neuroradiol 46 (5): 312-318. (requiere suscripción).
- ↑ Denève M.; Biotti D.; Dumas H.; Patsoura S.; Ferrier M.; Meluchova Z. et al. (2018). «Caractéristiques IRM des neuromyélites optiques associées aux anticorps anti-MOG». Journal of Neuroradiology 45 (2): 93-94. Consultado el 16 de setiembre de 2024. (requiere suscripción).
- ↑ Waters P.; Fadda G.;; Woodhall M.; O’Mahony J.; Brown RA.; Castro D. (2020). «Serial anti-myelin oligodendrocyte glyco-protein antibody analyses and outcomes in children with demyelinating syndromes». JAMA Neurol 77 (1): 82-93.
- ↑ Armangue, Thaís; Olivé-Cirera, Gemma; Martínez-Hernandez, Eugenia; Sepulveda, Maria; Ruiz-Garcia, Raquel; Muñoz-Batista, Marta. «Associations of paediatric demyelinating and encephalitic syndromes with myelin oligodendrocyte glycoprotein antibodies: a multicentre observational study». Lancet Neurol 19 (3): 234-246. (requiere suscripción).