Pentafluoruro de antimonio
El pentafluoruro de antimonio es un compuesto inorgánico con la fórmula SbF5 . Este líquido viscoso e incoloro es un valioso ácido de Lewis y un componente del ácido superácido fluoroantimónico, el ácido más fuerte conocido que se forma al mezclar HF líquido con SbF5 líquido en una proporción de 2:1. Es notable por su acidez de Lewis y su capacidad de reaccionar con casi todos los compuestos conocidos.[2]
| Pentafluoruro de antimonio | ||
|---|---|---|
| General | ||
| Fórmula estructural |
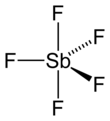 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7783-70-2[1] | |
| Número RTECS | CC5800000 | |
| ChEBI | 193146 | |
| ChemSpider | 14846333 22963, 14846333 | |
| PubChem | 90479450 24557, 90479450 | |
| UNII | 6C93R71VRF | |
| Propiedades físicas | ||
| Masa molar | 215,8958318 g/mol | |
Preparación
editarEl pentafluoruro de antimonio se prepara por reacción del pentacloruro de antimonio con fluoruro de hidrógeno anhidro:[3]
- SbCl5 + 5HF → SbF5 + 5HCl
También se puede preparar con trifluoruro de antimonio y flúor.[4]
Estructura y reacciones químicas.
editarEn la fase gaseosa, SbF5 adopta una estructura bipiramidal trigonal de simetría de grupo de puntos D3h (ver imagen). El material adopta una estructura más complicada en los estados líquido y sólido. El líquido contiene polímeros en los que cada Sb es octaédrica, la estructura que se describe con la fórmula [SbF4(μ-F)2]n ((μ-F) denota el hecho de que los centros de fluoruro puente dos centros de Sb). El material cristalino es un tetrámero, lo que significa que tiene la fórmula [SbF4(μ-F)]4. Los enlaces Sb-F son 2.02Å dentro del anillo Sb4F4 de ocho miembros; las ligas de fluoruro restantes que irradian desde los cuatro centros Sb son más cortos a 1,82 Å.[5] Las especies relacionadas PF5 y AsF5 son monoméricas en estado sólido y líquido, probablemente debido a los tamaños más pequeños del átomo central, lo que limita su número de coordinación. BiF5 es un polímero.[6]
De la misma manera que SbF5 mejora la acidez Brønsted de HF, aumenta el poder oxidante de F2 . Este efecto está ilustrado por la oxidación del oxígeno:[7]
- 2SbF5 + F2 +2O2 → 2[O2 ]+[SbF6]-
El pentafluoruro de antimonio también se ha utilizado en la primera reacción química descubierta que produce gas flúor a partir de compuestos de flúor:
- 4 SbF
5 + 2 K
2MnF
6 → 4 KSbF
6 + 2 MnF
3 + F
2
La fuerza impulsora de esta reacción es la alta afinidad de SbF5 por F−
, que es la misma propiedad que recomienda el uso de SbF5 para generar superácidos.
Hexafluoroantimonato
editarSbF5 es un ácido de Lewis fuerte, excepcionalmente así hacia fuentes de F- para dar el anión muy estable [SbF6]-, llamado hexafluoroantimoniato. [SbF6]- es un anión débilmente coordinado similar a PF<sub id="mwaQ">6</sub><sup id="mwag">-</sup>. Aunque solo es débilmente básico, [SbF6]- reacciona con SbF5 adicional para dar un aducto centrosimétrico:
- SbF
5 + [SbF
6]- → [Sb
2F
11]-
Seguridad
editarSbF5 reacciona violentamente con muchos compuestos, a menudo liberando fluoruro de hidrógeno peligroso. Es corrosivo para la piel y los ojos.[8][9]
Referencias
editar- ↑ Número CAS
- ↑ Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X.-y."Antimony(V) Fluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi 10.1002/047084289.
- ↑ Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig, Hans Uwe Wolf "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi 10.1002/14356007.a03_055.pub2
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 200.
- ↑ Edwards, A. J.; Taylor, P. "Crystal structure of Antimony Pentafluoride" Journal of the Chemical Society, Chemical Communications 1971, pp. 1376-7.doi 10.1039/C29710001376
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Shamir, J.; Binenboym, J. "Dioxygenyl Salts" Inorganic Syntheses 1973, XIV, 109-122. ISSN 0073-8077
- ↑ International Programme on Chemical Safety (2005). «Antimony pentafluoride». Commission of the European Communities (CEC). Consultado el 10 de mayo de 2010.
- ↑ Barbalace, Kenneth (2006). «Chemical Database - Antimony Pentafluoride». Environmental Chemistry. Consultado el 10 de mayo de 2010.