Pentano
Pentano es un hidrocarburo saturado o alcano con fórmula química C5H12.
| Pentano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Pentano | ||
| General | ||
| Otros nombres |
n-pentano Pentano normal | |
| Fórmula semidesarrollada | CH3CH2CH2CH2CH3 | |
| Fórmula molecular | C5H12 | |
| Identificadores | ||
| Número CAS | 109-66-0[1] | |
| Número RTECS | RZ9450000 | |
| ChEBI | 37830 | |
| ChEMBL | CHEMBL16102 | |
| ChemSpider | 7712 | |
| PubChem | 8003 | |
| UNII | 4FEX897A91 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 630 kg/m³; 0,63 g/cm³ | |
| Masa molar | 7215 g/mol | |
| Punto de fusión | 143,3 K (−130 °C) | |
| Punto de ebullición | 309,1 K (36 °C) | |
| Temperatura crítica | 469,8 K (197 °C) | |
| Presión crítica | 33.6 ± 0.6 atm | |
| Viscosidad | 0.240 cP at 20 °C | |
| Índice de refracción (nD) | 1.35768 (20 °C) | |
| Propiedades químicas | ||
| Acidez | -45 pKa | |
| Solubilidad en agua | 0.36 g/L a 20 °C | |
| Momento dipolar | 0.007 D D | |
| Termoquímica | ||
| ΔfH0gas | -146.8 ± 0.59 kJ/mol | |
| ΔfH0líquido | -173.5 ± 0.59 kJ/mol | |
| S0gas, 1 bar | 347.82 ± 0.84 J·mol–1·K | |
| S0líquido, 1 bar | 263.47 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 233 K (−40 °C) | |
| NFPA 704 |
4
1
0
?
| |
| Temperatura de autoignición | 533 K (260 °C) | |
| Frases R | R12, R20/22, R36/37/38 | |
| Frases S | S2, S7, S9, S16, S23.2, S28.1, S29, S33, S36, S61, S62[2] | |
| Límites de explosividad | 1,4 a 8,3% vol. | |
| Riesgos | ||
| Ingestión | Puede causar irritación del tracto digestivo. Los síntomas pueden incluir: dolor de cabeza, agitación, fatiga, náuseas, vómitos, estupor y coma. Puede causar irritación gastrointestinal con náuseas, vómitos y diarrea. Puede causar depresión del sistema nervioso central, caracterizada por excitación, seguido de dolor de cabeza, mareos, somnolencia y náuseas. En etapas avanzadas puede causar colapso, inconsciencia, coma y posible muerte por insuficiencia respiratoria. La aspiración del material en los pulmones puede causar neumonitis química, que puede ser mortal. La ingestión de grandes cantidades puede causar depresión del SNC. | |
| Inhalación | La inhalación de altas concentraciones puede causar efectos en el sistema nervioso central, caracterizado por dolor de cabeza, mareos, pérdida del conocimiento y coma. Puede causar irritación de las vías respiratorias. La aspiración puede provocar edema pulmonar. Los vapores pueden causar mareos o sofocación. Puede causar una sensación de ardor en el pecho. | |
| Piel | Causa irritación de la piel. Puede causar irritación y dermatitis. Puede causar cianosis de las extremidades. | |
| Ojos | Causa irritación de los ojos. Puede causar conjuntivitis química y daño de la córnea. | |
| Compuestos relacionados | ||
| Alcanos | Butano, Hexano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
A diferencia de los 4 primeros alcanos, que son gaseosos, el pentano se encuentra en forma líquida a temperatura ambiente.
La palabra pentano también puede referirse a sus isómeros estructurales, o a una mezcla de ellos. En la nomenclatura de la IUPAC, sin embargo, pentano es el nombre exclusivo del n-pentano; los otros dos isómeros de cadena reciben los nombres de metilbutano y dimetilpropano
| Nombre tradicional | pentano normal n-pentano pentano lineal n-pentano |
isopentano i-pentano |
neopentano |
| Nombre IUPAC |
pentano | metilbutano | dimetilpropano |
| Diagrama molecular |
 |
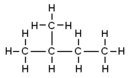 |
 |
| Diagrama del esqueleto |
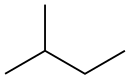 |
 |
Los pentanos son componentes de algunos combustibles y se emplean como disolvente de laboratorio. Sus propiedades son muy similares a las de los butanos y hexanos.y
Usos industriales
editarEl n-pentano es uno de los agentes espumantes primarios que se usan en la producción de espuma de poliestireno.
Debido a su bajo punto de ebullición, bajo coste, y relativa seguridad, el pentano se usa como medio de trabajo en las centrales de energía geotérmica.
Usos en laboratorio
editarLos pentanos son relativamente baratos y son los alcanos, líquidos a temperatura ambiente, más volátiles, por lo que se usan en laboratorio como disolventes que se evaporan con facilidad. Sin embargo, debido a su falta de polaridad y ausencias de grupos funcionales, solo pueden disolver sustancias no-polares y compuestos ricos en grupos alquilo. Los pentanos son miscibles con la mayoría de los disolventes no-polares como clorocarbonos, derivados aromáticos y étc. También se usan con frecuencia en cromatografía en fase líquida.
Propiedades físicas
editar| Isómero | Temp de Fusión (°C)[3] | Temp. de ebullición (°C)[3] | Densidad (g/l)[3] |
| n-pentano | -129.8 | 36.1 | 621 |
| isopentano | -159.9 | 27.9 | 616 |
| neopentano | -16.6 | 9.5 | 586 |
Los puntos de ebullición de los isómeros del pentano están en el rango de 9 a 36 °C. Igual que ocurre con otros alcanos, los isómeros más ramificados tienden a tener menores puntos de ebullición.
Por otra parte, el punto de fusión del isopentano es sólo 30 °C inferior que el de n-pentano, pero el de neopentano es más de 100 °C superior al de isopentano. La anomalía se ha atribuido al mejor empaquetamiento en el estado sólido que se asume como posible para la molécula tetraédrica de neopentano. También se debe considerar, por igual motivo, que neopentano tiene una menor densidad que los otros dos isómeros.[3]
Los isómeros ramificados son más estables tienen menor calor de formación y calor de combustión que el pentano normal. La diferencia es de 1.8 kcal/mol para isopentano, y 5 kcal/mol para neopentano.[4]
La rotación sobre el eje del enlace químico simple C-C del n-pentane produce cuatro diferentes isómeros conformacionales.[5]
Reacciones
editarTodos los isómeros de pentano arden con oxígeno para formar dióxido de carbono y vapor de agua:
- C5H12 + 8 O2 → 5 CO2 + 6 H2O
Como otros hidrocarburos, los pentanos sufren reacciones de sustitución con halógenos, (por ejemplo cloración) por el mecanismo de radicales libres.
- C5H12 + Cl2 → C5H11Cl + HCl
Tales reacciones no son selectivas; con n-pentano, el resultado es una mezcla de 1-cloropentano, 2-cloropentano, y 3-cloropentano, así como otros derivados clorados más sustituidos.
A pesar de que el n-butano es la materia prima convencional para la producción de anhídrido maleico, n-pentano es también usado como substrato para su fabricación:
- CH3CH2CH2CH2CH3 + 5 O2 → C2H2(CO)2O + 5 H2O + CO2
Véase también
editarReferencias
editar- ↑ Número CAS
- ↑ Hoja de datos de seguridad MSDS. Cicarelli, Reagents S.A.
- ↑ a b c d James Wei (1999), Molecular Symmetry, Rotational Entropy, and Elevated Melting Points. Ind. Eng. Chem. Res., volume 38 issue 12, pp. 5019–5027 {{doi:10.1021/ie990588m}}
- ↑ A partir de los valores listados en Standard enthalpy change of formation (data table).
- ↑ Roman M. Balabin (2009). «Enthalpy Difference between Conformations of Normal Alkanes: Raman Spectroscopy Study of n-Pentane and n-Butane». J. Phys. Chem. A 113 (6): 1012. doi:10.1021/jp809639s.
Enlaces externos
editar- Wikimedia Commons alberga una galería multimedia sobre Pentano.
- Ficha de seguridad MSDS sobre n-pentano en Cicarelli Reagents S.A.
