Rallus aquaticus
El rascón europeo o rascón común (Rallus aquaticus)[2] es una especie de ave gruiforme de la familia Rallidae propia de los carrizales y cañaverales de Eurasia y el norte de África. Sus poblaciones septentrionales y orientales son migratorias, pero las que viven en las zonas más cálidas son sedentarias. Los adultos miden entre 23 y 28 cm de largo, y como otros rállidos tienen el cuerpo aplanado lateralmente para pasar más fácilmente entre los cañaverales donde viven. El plumaje de sus partes superiores es de tonos pardos con veteado oscuro, y sus partes inferiores son principalmente de color gris azulado, con listado blanco y negro en los flancos y bajo vientre. Tienen un pico largo y rojizo, largos dedos y la cola corta. Los inmaduros tienen las partes inferiores anteadas y los polluelos son negros. Anteriormente se clasificaba al rascón asiático (R. indicus) como una subespecie de rascón común pero ahora se consideran especies separadas.
| Rascón | ||
|---|---|---|
 | ||
| Estado de conservación | ||
 Preocupación menor (UICN 3.1)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Aves | |
| Orden: | Gruiformes | |
| Familia: | Rallidae | |
| Género: | Rallus | |
| Especie: |
R. aquaticus Linnaeus, 1758 | |
| Distribución | ||
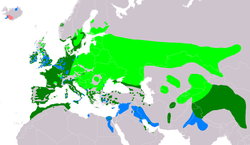 Distribución de Rallus aquaticus Área de cría. Área de ocupación permanente. Área de invernada. Área de probablemente extinto. | ||
El rascón europeo vive en humedales con vegetación palustre alta y densa, donde se alimenta principalmente de pequeños animales. Son aves territoriales incluso fuera de la época de cría.
Descripción
editarLos adultos de la subespecie nominal miden entre 23–28 cm de largo y tienen una envergadura alar de 38–45 cm. Los machos generalmente pesan entre 114–164 g y las hembras son ligeramente menores con un peso de 92–107 g.[3] Sus partes superiores, desde la frente a la cola, son de color pardo oliváceo con veteado negro, especialmente en los hombros. Los laterales de la cabeza y sus partes inferiores hasta la parte superior del vientre son de color gris azulado, salvo el lorum que es negruzco, y los laterales parduzcos del pecho. Sus flancos y bajo vientre están listados en blanco y negro, y la zona infracaudal es blanca con algunas estrías oscuras. Su largo pico y recto pico y el iris de sus ojos son rojos, y sus patas son parduzcas. Ambos sexos son de aspecto similar, aunque las hembras son algo menores y su pico es más estrecho,[4] por lo que no es fácil diferenciarlos por sus dimensiones.[5] Los juveniles tienen el píleo negruzco y la barbilla y garganta blancas. Sus partes inferiores son anteadas o blanquecinas con listado más oscuro, y sus flancos tienen listado pardo y crema, en lugar de blanco y negro. Su zona infracaudal también es anteada, y la coloración de sus ojos, pico y patas es menos intensa que en los adultos. Los polluelos son completamente negros salvo el pico que es casi todo blanco.[4] Tras la época de cría los rascones tienen una muda completa del plumaje, y se quedan sin capacidad para volar unas tres semanas.[1] Los adultos pueden ser identificados individualmente por las marcas de su zona infracaudal, que son únicas en cada ave. Los machos adultos tienen las estrías de esta zona de un negro más intenso.[6] Se ha sugerido que estas manchas oscuras bajo la cola de la especie es una situación intermedia entre las funciones de señalización del blanco puro que tienen especies las especies gregarias o de aguas abiertas gallineta común, y la necesidad de evitar ser tan llamativo.[7]
El rascón europeo puede distinguirse rápidamente del resto de rállidas palustres por su largo pico rojo y su zona infracaudal blanca. Su pico es un poco más largo que el resto resto de su cabeza (55–58% del total) y aunque recto está ligeramente curvado hacia abajo.[8] El rascón rufigrís del Asia tropical es un tanto similar pero tiene el pico más robusto, el píleo castaño rojizo y las partes superiores y flancos salpicados de motas blancas. Los juveniles y los rascones desplumados por la muda pueden mostrar la parte infracaudal color crema como la polluela pintoja, pero esta especie también está cubierta de motas blancas y tiene el pico mucho más corto y amarillento. El área de distribución del rascón común únicamente solapa mínimamente (al sur de China y norte de Birmania) con otra especie del género Rallus, el rascón asiático, del que se diferencia principalmente por la coloración parduzca de las partes inferiores y la marcada lista ocular de este último. El rascón cafre es más grande, tiene las partes superiores más oscuras y sin veteado y sus patas son de un rojo más intenso. Además los rascones europeos divagantes pueden diferenciarse de sus parientes americanos por la ausencia de tonalidades castañas o rojizas en sus alas plegadas.[4]
Sonidos
editarEl rascón europeo es una especie ruidosa que emite gruñidos y gritos todo el año. Su llamada característica consiste en una serie de gruñidos seguidos de un grito agudo y terminada con más gruñidos. La usa como reclamo territorial, llamada de alarma e invitación. Los miembros de una pareja pueden emitirla alternativamente, siendo la del macho más baja y lenta que la de su pareja. El canto de cortejo, producido por ambos sexos, consiste en un tyick-tyick-tyick con frecuencia terminado en un gorjeo de la hembra. El macho puede cantar en solitario durante horas. Su llamada durante el vuelo es un silbido áspero. Además poseen otras vocalizaciones como los chirridos altos y repetidos del macho cuando le enseña el sitio de anidamiento a la hembra, o el ronroneo que dan ambos progenitores a sus polluelos. Los rascones son más ruidosos cuando establecen un territorio y al principio de la época de cría, cuando las llamadas pueden continuar incluso por la noche. Los polluelos al principio pían débilmente, pero pronto desarrollan un reclamo para pedir de tipo tyk-tyk-trik.[4]
Se descubrió intentando atrapar carriceros comunes para estudiarlos mediante reproducciones por la noche de su canto grabado que también acudían rascones y otras aves acuáticas, aunque se hiciera en hábitats desfavorables, lo que indicaba que los rascones y otras aves migratorias nocturnas identifican los cantos del carricero con el hábitat pantanoso donde normalmente se encuentra.[9]
Taxonomía y etimología
editarEl rascón europeo es la especie tipo del género Rallus y la familia Rallidae, una familia de aves acuáticas y semiacuáticas de tamaño medio, aunque pequeñas en comparación con el resto de Gruiformes, de cuello más corto que el de las grullas, cola corta, patas robustas con dedos largos y plumajes discretos. La familia agrupa unas 150 especies de aves. La mayoría de ellas, y las formas más arcaicas, se encuentran en el Viejo mundo, lo que indica que allí está su origen. Por el contrario, el género Rallus surgió en América. Los tres miembros del Viejo mundo: el rascón europeo, el rascón cafre y el malgache, están próximamente emparentados y forman una superespecie, por haber evolucionado a partir de un único ancestro proveniente de una invasión americana a través del Atlántico.[10] Las pruebas genéticas indican el rascón europeo es el miembro de su género más próximamente emparentado con los rascones del género Gallirallus del pacífico,[11] y es una forma basal del grupo.[12] Los miembros de Rallus se caracterizan por tener picos largos y coloridos sin los característicos escudos frontales de la mayoría de los rállidos y ser de hábitos palustres.
El rascón común fue descrito científicamente por Carlos Linneo en 1758 en la décima edición de su obra Systema naturae,[13] con su nombre científico actual, Rallus aquaticus.[14] La etimología de su nombre científico es simple: Rallus en latín significa «rascón», y aquaticus significa «acuático».[15]
Se reconocen tres subespecies de rascón común:[16][4]
- Rallus aquaticus aquaticus Linnaeus, 1758 - se extiende por Europa, el norte de África y el oeste de Asia, llegando hasta Siberia central.
- Rallus aquaticus hibernans Salomonsen, 1931 † - vivía en Islandia. Tenía las partes superiores de tonos pardos algo más cálidos que la subespecie nominal, y sus partes inferiores tenían un tono parduzco. Las listas de sus flancos eran de color pardo oscuro, no negro, y su pico era algo más corto.[4]
- Rallus aquaticus korejewi Zarudny, 1905 - se encuentra por Asia desde Irán y el mar Aral hasta el norte del subcontinente indio y el oeste de China. Es ligeramente mayor que la subespecie nominal y con plumaje más claro en general. Tiene una lista difusa parda cruzando su ojo.[4][17]
Anteriormente se consideraba al rascón asiático (Rallus indicus) subespecie del común pero ahora se clasifica como una especie separada.
Distribución y hábitat
editarEl rascón europeo crían por el Holartico templado, distribuido discontinuamente desde Europa occidental y el norte de África, hasta el oeste de China y Arabia. Su distribución asiática está poco estudiada.[4]
La población de Islandia de rascón común, R. a. hibernans, se extinguió alrededor de 1965, como resultado de la pérdida de hábitat por la desecación de humedales y la depredación sufrida por parte del visón americano introducido en la isla.[18] Antes de su extinción parte de esta población de rascones isleños se quedaba todo el año en Islandia, dependiente de los manantiales volcánicos calientes en los meses más fríos, pero otra en invierno se encontraba en las islas Feroe e Irlanda, pasando por las Hébridas Exteriores, lo que indicaba que esta subespecie era parcialmente migratoria.[19]
La subespecie nominal, R. a. aquaticus, es sedentario en las zonas de clima más suave del sur y oeste de su área de distribución, pero migra al sur en las zonas donde los inviernos son más duros. Pasan el invierno tanto en su zona de cría más meridional, como en más al sur en el norte de África, Oriente medio y la zona del mar Caspio. La cumbre del periodo de migración otoñal es de septiembre a octubre, y la mayoría regresa a sus cuarteles de reproducción entre marzo y mediados de abril.[19] La subespecie R. a. korejewi también es migratoria parcialmente, y parte de la población pasa el invierno desde Irak y Arabia Saudí, Pakistán y el norte de la India, hasta el este de China.[4]
Los hábitats de cría del rascón son los humedales permanentes de aguas estancadas o lentas, dulces o negras y con vegetación densa y alta, como los carrizales, juncales, espadañas, lirios, esparganios o juncias.[4] En las zonas costeras, los lechos de juncos marinos de las marismas son su lugar de cría, con los juncos y los esparganios como especies dominantes en los ambientes menos salobres. Un estudio realizado en Países Bajos y España mostró que los juncos proporcionaban mejor cobertura que otras plantas marítimas. En todos los sitios sus nidos están construidos con las plantas circundantes.[20] El hábitat preferido de los rascones son los carrizales (Phragmites) con plantas surgiendo del agua,[21] con una profundidad de entre 5–30 cm, barrizales para alimentarse y con gran diversidad de especies de invertebrados. Además prefieren los emplazamientos cercanos a los sauces y matorrales que las grandes áreas de hábitat uniforme. Donde se encuentran, los juncos espigados proporcionan una buena alternativa como hábitat de cría, su altura (1,5 m) y densa estructura proporciona una buena cobertura para el nido de los rascones.[22] Además de los pantanos y marismas naturales el rascón también puede usar las resultantes de las extracciones de grava, arena o turba en cuanto recobran la cubierta vegetal suficiente. También puede encontrarse en los cultivos de arroz o en islas flotantes,[4] y en Kachemira ocupan las plantaciones de caña de azúcar inundadas.[17] Un estudio finlandés mostró que el principal factor que influye en la distribución de los rascones europeos es la extensión de la cubierta vegetal, estando las densidades de población más altas en las zonas con más densidad vegetal, aunque la cercanía de otros pantanos también era un factor significativo. Sin embargo, otros factores como la temperatura, la pluviosidad, la longitud de la línea costera o la extensión de la turbera, que son importantes para otras aves palustres, no son relevantes estadísticamente para los rascones. Las áreas con las mayores densidades de rascones también tenían las mayores densidades de otras tres especies de aves consideradas en peligro en Finlandia: el carricero tordal, el avetoro y el aguilucho lagunero occidental.[23] El límite septentrional del área de cría del rascón parece estar determinado por la transición entre los humedales ricos en nutrientes y los más pobres y de aguas más ácidas. Esto produce que los carrizos comunes sean reemplazados por una vegetación más abierta dominada por la especie Comarum palustre, que es inapropiada para los rascones.[24]
Ocasionalmente se encuentra en emplazamientos más inusuales. Una pareja de rascones anidó en Escocia al raso la cuneta de una carretera, y cuando una reserva natural de Inglaterra instaló cajas nido para los bigotudos (casetas de caña con suelo de madera) los rascones anidaron tanto en la caseta como bajo el suelo de madera, en este último caso con los bigotudos instalados encima dentro de la caja.[25] Aunque son una especie de zonas bajas, los rascones europeos crían a 1,240 m en los Alpes y 2,000 m en Armenia.[4] Un estudio italiano indica que las aves que crían en los lechos de juncos necesitan un área mínima de humedal, que en el caso de los rascones es de 1 ha,[26] aunque las mayores densidades se encontraban en pantanos de 10 ha o más.[23]
Durante la migración o en invierno pueden usar un espectro más amplio de hábitats húmedos, como las zonas de helechos y de matorral inundados. Las heladas pueden obligar a los rascones a desplazarse a zonas más abiertas como las acequias, vertederos y parques,[4] o incluso a permanecer expuestos sobre el hielo.[27] Un estudio mostró que en invierno los territorios de cada individuo se solapan, que cada rascón usaba una proporción significativa del cañaveral, y que los rascones regresan a su anterior área de distribución pasado el invierno. Este estudio registró una densidad de 14 rascones por hectárea.[28] Los rascones que se quedaban en Islandia durante el invierno dependían de las aguas geotermales a las que accedían por túneles bajo la nieve. Cuando no se estaban alimentando se refugiaban en cavidades y grietas entre la lava solidificada.[4] Esta especie a veces se encuentra como divagante lejos de su área de distribución normal habiéndose registrado en Azores, Madeira, Mauritania, el Ártico,[19] Groenlandia, Malasia y Vietnam.[1]
Comportamiento
editarEl rascón es una especie discreta, difícil de ver en su hábitat ya que se mimetiza gracias a su plumaje veteado. Su cuerpo compacto lateralmente le permite deslizarse entre la vegetación densa, y se queda inmóvil si es sorprendido en zona abierta.[29] Suele caminar erguido erguido, pero adopta una postura agachada cuando corre para esconderse. Nada cuando es necesario, balanceando el cuello delante y atrás como es típico en los rallidos,[19] y suele volar bajo cerca de las cañas con sus largas patas colgando, generalmente cortas distancias. Aunque su vuelo parece pesado los rascones son capaces de realizar vuelos de larga distancia durante sus migraciones nocturnas,[17] y a veces muere por colisión con los faros y cables eléctricos.[29] Individuos anillados en las islas británicas han sido recobrados tan lejos como en Polonia, Checoslovaquia y Suecia.[30]
Es una especie territorial que defiende su territorio tanto en época de cría como durante la invernada. Los rascones cargan unos contra otros con el cuello extendido en la época de cría, y a veces atacan juntos los dos miembros de la pareja. Los machos grandes densamente veteados son dominantes en invierno, cuando las agresiones directas se sustituyen exhibiciones situándose de puntillas en posición erguida, mientras se realizan movimientos de cabeza y se emiten sonidos de amenaza.[4]
Alimentación
editarEl racón europeo son omnívoros, aunque se alimentan principalmente de pequeños animales. Su dieta incluye gusanos, sanguijuelas, gasterópodos, pequeños crustáceos, arañas y una gran variedad de insectos acuáticos y terrestres y sus larvas. También comen pequeños vertebrados como anfibios, peces, aves y mamíferos que pueden matar o comer su carroña. Mata a los pequeños vertebrados atravesándolos con su pico de un golpe que rompe la columna de su presa. También consume productos vegetales, especialmente en otoño e invierno, como brotes, flores, semillas de plantas acuáticas y frutos.[4] En el sur de Asia a veces también consumen arroz.[17] Los rascones jóvenes se alimentan principalmente de insectos y arañas. Consiguen su alimento en tierra o entre el barro, y normalmente la lavan en el agua antes de comerla.[4] Después de la lluvia los rascones sondean el suelo blando con su pico para encontrar lombrices.[6] En ocasiones esta especie se alimenta en praderas abiertas y otros hábitats despejados cuando les obliga el frío.[31] A pesar de su naturaleza tímida se puede mantener en cautividad a los rascones alimentándolos con carne cruda o lombrices.[32]
Los rascones siguen rutas definidas cuando se alimentan, y con frecuencia vuelven a las buenas zonas de caza. Los rascones europeos son versátiles y oportunistas a la hora de alimentarse. Pueden saltar para atrapar insectos en las plantas, trepar para alcanzar bayas y arrancar manzanas del árbol para poder comérselas en el suelo.[4] Pueden matar otras aves atravesándolas con el pico o ahogándolas, especialmente aquellas con su capacidad para escapar reducida. En los aviarios pueden matar a aves más pequeñas y también matan a los pájaros atrapados en las redes de anillar.[25]
Reproducción
editarEl rascón europeo es monógamos y muy territoriales en la época de cría. Los rascones se emparejan tras llegar a sus zonas de cría o antes de la migración primaveral. En los humedales grandes en buen estado los rascones anidan a 20–50 m unas de otros. El tamaño del territorio varía, pero la media es de 300 m². La pareja emite reclamos de cortejo y llamadas de contacto durante toda la época de cría. Los machos eligen el emplazamiento del nido y se lo muestran a las hembras con una exhibición en la que erizan las plumas de la espalda, arquean las alas sobre la espalda, despliegan la cola y apuntan hacia abajo con el pico verticalmente. Esta exhibición va acompañada de un ronroneo alto. Antes de aparearse el macho alza sus alas y cola, y agacha la cabeza tocando el pecho con el pico. Durante el cortejo el macho alimenta a la hembra y también durante la incubación, entonces ella deja el nido y realiza una exhibición ante el macho, caminando alrededor de él, emitiendo llamadas suaves, y frotando su pico contra el de él y dando carreras cortas hasta y desde donde está él.[4]
El nido se sitúa en cualquier lugar entre la vegetación palustre y es construido principalmente por el macho, generalmente en un solo día. Suele elevarse unos 15 cm o más por encima del nivel del marjal, y a veces se sitúa en entramados de raíces, tocones de árboles y otros soportes similares. Si el nivel del agua empieza a subir lo hacen más grande. El nido suele tener un diámetro de entre 13–16 cm y unos 7 cm de alto. El nido está bien escondido entre la vegetación y se acercan a él cautelosamente por sendas estrechas.[4][29][33]
La puesta típica se compone de 6–11 huevos en la mayor parte de su área de distribución,[4][19] aunque parecen ser más pequeñas (5–8) en Kachemira a unos 1500 m de altitud.[17] La fecha de las puestas varía según la localización, se produce desde finales de marzo en Europa occidental y el norte de África, hasta finales de mayo en Kachemira y junio en Islandia.[4] El tamaño de la nidada puede reducirse en las puestas tempranas y tardías de la estación de cría.[34] La época de cría puede extenderse para realizar segundas puestas y puestas de repuesto. Sus huevos son suaves y ligeramente brillantes. Su color varía del blanquecino al crema rosado, con moteado pardo rojizo concentrado principalmente en el extremo más ancho,[19] que a veces se extienden en una sola banda.[33] La variación del tamaño de los huevos entre las tres subespecies es menor que las diferencias individuales. El tamaño medio de los huevos de la subespecie nominal es de 36 × 26 mm. Los huevos pesan 13 g,[4] de los cuales 7% corresponde a la cáscara.[35]
Ambos progenitores incuban los huevos, aunque las hembras incuban la mayor parte del tiempo.[17] La incubación dura 19–22 días hasta la eclosión,[35] y eclosionan al menos el 87%.[30] El adulto que no está con los polluelos lleva comida al que está en el nido para que los alimente. Los polluelos son precoces, y en un par de días tras la eclosión dejan el nido, pero siguen siendo alimentados por sus padres, aunque también consiguen su propia comida al cabo de unos cinco días.[4] Son independientes de sus padres a los 20–30 days[35] y pueden volar cuando tienen 7–9 semanas.[4] Si el nido corre el peligro de ser descubierto, la hembra acarrea a los polluelos o los huevos con el pico de uno en uno, hasta otro emplazamiento,[29] aunque los polluelos pequeños también pueden ser transportados bajo las alas.[25] Los rascones que están incubando pueden permanecer sobre los huevos incluso si un intruso se acerca mucho, o bien lo atacan o pueden fingir estar heridos para distraerlo.[4] Los rascones pueden criar al año de haber nacido, y generalmente realizan dos nidadas por temporada.
La supervivencia media para los rascones nuevos se estima entre 17 y 20 meses, con una tasa de supervivencia anual ligeramente menor del 50% durante los tres primero años, y ligeramente mayor después.[30] La edad máxima registrada es de 8 años y 10 meses.[35]
Depredadores y parásidos
editarEntre los depredadores del rascón europeo se incluyen varios mamíferos, rapaces y otras aves grandes. El visón americano es en parte el responsable de la extinción de la población de Islandia,[18] y también se ha registrado que los gatos y perros también matan a esta especie.[30] Al menos localmente también las nutrias también pueden comer rascones y otras aves acuáticas.[37] El avetoro, otra ave de los carrizales, también consume polluelos de rascones,[38] al igual que la garza real.[39] Los rascones europeos son particularmente vulnerables a las garzas cuando son forzados a salir a descubierto por las mareas muy altas.[25] Los aguiluchos que cazan en los humedales se cuentan entre sus principales depredadores,[40] pero con menos frecuencia también son cazados por los cárabos,[41] los búhos campestres,[42] los búhos reales,[43] las águilas moteadas,[44] los cernícalos comunes,[45] y los halcones peregrinos.[46]
Entre sus parásitos se incluyen los piojos chupadores Nirmus cuspidiculus y Pediculus ralli,[47][48] la garrapata Ixodes frontalis,[49] y la mosca piojo Ornithomyia avicularia.[50] Los rascones europeos pueden resultar infectados por el virus de la gripe aviaria,[51][52] y la bacteria Borrelia burgdorferi, portada por las garrapatas Ixodes, que también pueden infectar a los humanos causando la enfermedad de Lyme.[53] Se han descubierto tres clases de piojos, Fulicoffula rallina, Pseudomenopon scopulacorne y Rallicola cuspidatus en rascones muertos en 2005 en las islas Feroe que no se habían encontrado hasta entonces en el archipiélago.[54] Se ha registrado al platelelminto parásito Ophthalmophagus nasciola en el seno nasal de un rascón,[55] y se han detectado al menos tres especies de ácaros de las plumas en su plumaje.[56]
Estado de conservación
editarLas poblaciones de rascón europeo está en declive, pero tiene una población grande de entre 100.000–1.000.000 adultos y un área de cría estimado de unos 15.600.000 km² por lo que se clasifica como especie bajo preocupación menor en la Lista Roja de la UICN.[1] En la mayoría de los países de Europa su población es estable o desciende ligeramente debido a la pérdida de hábitat. La población y el área de distribución del rascón se está incrementando en Marruecos, y cría tan al sur como Souss Massa.[19] Se sabe poco de la población asiática, pero la subespecie korejewi es común en Pakistán y Kachemira.[57]
Localmente sus hábitats están resultando afectados por la desecación de humedales, la canalización de cursos de agua y la expansión urbana,[58] además de la contaminación.[59] Los depredadores introducidos son una amenaza para las poblaciones isleñas vulnerables. Además de la extinción local de la subespecie islandesa, los visones son responsables de los marcados declives de la población de rascones y otras aves que anidan en el suelo de las Hébridas, donde la nutria que come principalmente peces era el único carnívoro nativo. Los visones procedían de granjas peleteras de Lewis,[60] desde donde se expandieron por Harris, North Uist y South Uist.[61] Los programas de erradicación de visones y hurones han permitido que los rascones regresen a islas como Lewis y Harris,[62] y se están llevando a cabo más proyectos similares en el resto de Escocia.[63]
Los rascones han sido consumidos por los humanos durante miles de años;[64] los antiguos romanos los comían,[65][66] y los representaron en pinturas en las paredes de Pompeya,[67] y su consumo siguió durante la Edad Media y hasta la época moderna.[68]
Referencias
editar- ↑ a b c d BirdLife International (2009). «Rallus aquaticus». Lista Roja de especies amenazadas de la UICN 2010.4 (en inglés). ISSN 2307-8235. Consultado el 14 de diciembre de 2010.
- ↑ Bernis, F; De Juana, E; Del Hoyo, J; Fernández-Cruz, M; Ferrer, X; Sáez-Royuela, R; Sargatal, J (1996). «Nombres en castellano de las aves del mundo recomendados por la Sociedad Española de Ornitología (Tercera parte: Opisthocomiformes, Gruiformes y Charadriiformes)». Ardeola. Handbook of the Birds of the World (Madrid: SEO/BirdLife) 43 (2): 231-238. ISSN 0570-7358. Consultado el 23 de mayo de 2014.
- ↑ CRC Handbook of Avian Body Masses by John B. Dunning Jr. (Editor). CRC Press (1992), ISBN 978-0-8493-4258-5.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y Taylor & van Perlo (2000) pp. 293–299
- ↑ Fuertes, Benito; García, Javier; Fernández, Juan; Suárez-Seoane, Susana; Arranz, Juan José (2010). «Can Iberian Water Rail Rallus aquaticus be sexed reliably using simple morphometrics?». Ringing & Migration 25: 42-46. doi:10.1080/03078698.2010.9674413.
- ↑ a b Ripley, S Dillon; Beehler, Bruce M (1985). Rails of the World, a compilation of new information 1975–1983 (Aves: Rallidae): Smithsonian Contributions to Zoology number 417. Washington, DC: Smithsonian Institution Press. p. 8.
- ↑ Stang, Alexandra T; McRae, Susan B (2009). «Why some rails have white tails: the evolution of white undertail plumage and anti-predator signaling». Evolutionary Ecology 23: 943-961. doi:10.1007/s10682-008-9283-z. Archivado desde el original el 27 de julio de 2011.
- ↑ Brown, Roy; Ferguson, John; Lawrence, Mike; Lees, David (1987). Tracks and Signs of the Birds of Britain and Europe. Bromley, Kent: Christopher Helm. p. 208. ISBN 0-7470-0201-0.
- ↑ Herremans, Marc (1990). «Body-moult and migration overlap in Reed Warblers (Acrocephalus scirpaceus) trapped during nocturnal migration». De Giervalk/Le Gerfaut 80: 149-158.
- ↑ Taylor & van Perlo (2000) p. 29
- ↑ Christidis, Les; Boles, Walter (2008). Systematics and taxonomy of Australian birds. Collingwood, Victoria: CSIRO. p. 120. ISBN 0-643-06511-3.
- ↑ Trewick, S A (1997). «Flightlessness and phylogeny amongst endemic rails (Aves: Rallidae) of the New Zealand region». Philosophical Transactions of the Royal Society of London B 352 (1352): 429-446. PMC 1691940. PMID 9163823. doi:10.1098/rstb.1997.0031.
- ↑ Zoonomen. «Taxonomía de Gruiformes.» (en inglés). Consultado el 21 de mayo de 2015.
- ↑ Caroli Linnæi. Systema naturæ per regna tria naturæ, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis Editio decima reformata 1758, Holmiæ, Impensis direct. Laurentii Salvii (Salvius publ.) p. 153.
- ↑ James A. Jobling. Helm Dictionary of Scientific Bird Names. Bloomsbury Publishing p. 52 y 330 ISBN 1408125013
- ↑ Frank Gill y David Donsker. Rails, gallinules & cranes Archivado el 6 de mayo de 2014 en Wayback Machine.. IOC World Bird List versión 5.1.
- ↑ a b c d e f Ali, Salim; Ripley, S Dillon (1980). Handbook of the Birds of India and Pakistan: Volume 2: Megapodes to Crab Plover (2 edición). New Delhi: OUP India. pp. 149-151. ISBN 0-19-565935-X.
- ↑ a b Tavares, Erika S; de Kroon, Gerard H J; Baker, Allan J (2010). «Phylogenetic and coalescent analysis of three loci suggest that the Water Rail is divisible into two species, Rallus aquaticus and R. indicus». Evolutionary Biology 10 (226): 1-12. doi:10.1186/1471-2148-10-226.
- ↑ a b c d e f g Snow, David; Perrins, Christopher M (editors) (1998). The Birds of the Western Palearctic concise edition, volume 1). Oxford: Oxford University Press. pp. 584-587. ISBN 0-19-854099-X.
- ↑ De Kroon, Gerard H J (2004). «A comparison of two European breeding habitats of the Water Rail Rallus aquaticus». Acta Ornithologica 39 (1): 21-27. doi:10.3161/0001645044213992.
- ↑ Jenkins, Richard K B; Ormerod, Steve J (2002). «Habitat preferences of breeding Water Rail Rallus aquaticus: Surveys using broadcast vocalizations during the breeding season found that Water Rail were significantly more abundant at sites that contained the most wet reed Phragmites sp». Bird Study 49 (1): 2-10. doi:10.1080/00063650209461238.
- ↑ de Kroon, Gerard H J; Mommers, Maria H J (2002). «Breeding of the Water Rail Rallus aquaticus in Cladium mariscus vegetation». Ornis Svecica 12: 69-74.
- ↑ a b Virkkala, Raimo; Luoto, Miska; Heikkinen, Risto K; Leikola, Niko (2005). «Distribution patterns of boreal marshland birds: modelling the relationships to land cover and climate». Journal of Biogeography 32 (11): 1957-1970. doi:10.1111/j.1365-2699.2005.01326.x.
- ↑ de Kroon, Gerard H J; Mommers, Maria H J (2003). «Why is the Water Rail Rallus aquaticus a very scarce breeder north of 61°N?». Ornis Svecica 13: 47-52.
- ↑ a b c d Cocker, Mark; Mabey, Richard (2005). Birds Britannica. London: Chatto & Windus. pp. 175–177. ISBN 0-7011-6907-9.
- ↑ Celada, Claudio; Bogliani, Giuseppe (1993). «Breeding bird communities in fragmented wetlands». Italian Journal of Zoology 60 (1): 73-80. doi:10.1080/11250009309355794.
- ↑ Mullarney, Killian; Svensson, Lars; Zetterstrom, Dan; Grant, Peter (1999). Collins Bird Guide. London: Collins. p. 124. ISBN 0-00-219728-6.
- ↑ Jenkins, Richard K B; Buckton, S T; Ormerod Steve J (1995). «Local movements and population density of Water Rails Rallus aquaticus in a small inland reedbed». Bird Study 42 (1): 82-87. doi:10.1080/00063659509477152.
- ↑ a b c d Coward (1930) pp. 319–321
- ↑ a b c d Flegg, J J M; Glue, David E (1973). «A Water Rail study». Bird Study 20 (1): 69-80. doi:10.1080/00063657309476360.
- ↑ Meade-Waldo, Edmund (1909). «The Water Rail». The Aviculturalist 7: 176.
- ↑ Yarrell, William (1894). A history of British birds, volume 3. London: J Van Voorst. pp. 25-26.
- ↑ a b Seebohm, Henry (1896). Coloured Figures of the Eggs of British Birds. Sheffield: Pawlson & Brailsford. p. 86.
- ↑ Jenkins, Richard K B (1999). «The breeding biology of the Water Rail Rallus aquaticus in Britain and Ireland». Bird Study 46 (3): 305-308. doi:10.1080/00063659909461143.
- ↑ a b c d «Water Rail Rallus aquaticus (Linnaeus, 1758)». BTOWeb BirdFacts. British Trust for Ornithology. Consultado el 14 de abril de 2011.
- ↑ Edwards (1991) p. 886
- ↑ de la Hey, Daniel Charles (2008). «The importance of birds in the diet of otter Lutra lutra on Shapwick Heath». Bioscience Horizons 1 (2): 143-147. doi:10.1093/biohorizons/hzn018.
- ↑ Crisp, Edward (1856). «Observations on Strongylus filaria and Botaurus stellaris». Proceedings of the Zoological Society of London 24: 54.
- ↑ Coward (1930) p. 85
- ↑ Clarke, Roger; Bourgonje, André; Castelijns, Henk (1993). «Food niches of sympatric Marsh Harriers Circus aeruginosus and Hen Harriers C. cyaneus on the Dutch coast in winter». Ibis 135 (4): 424- 431. doi:10.1111/j.1474-919X.1993.tb02115.x.
- ↑ Yalden, D W (1985). «Dietary separation of owls in the Peak District». Bird Study 32 (2): 122-131. doi:10.1080/00063658509476867.
- ↑ Glue, David E (1977). «Feeding ecology of the Short-eared Owl in Britain and Ireland». Bird Study 24 (2): 70-78. doi:10.1080/00063657709476536.
- ↑ Bayle, Patrick; Prior, Richard (2006). «Prey species of Eagle Owl Bubo bubo in Lebanon». Sandgrouse 28 (2): 167-168. Archivado desde el original el 10 de marzo de 2012. Consultado el 25 de mayo de 2015.
- ↑ Alivizatos, Haralambos; Papandropoulos, Dimitris; Zogaris, Stamatis (2004). «Winter diet of the Greater Spotted Eagle (Aquila clanga) in the Amvrakikos wetlands, Greece». Journal of Raptor Research 38 (4): 371-374.
- ↑ Cavé, Antonius Johannes (1968). «The breeding of the kestrel, Falco tinnunculus L. in the reclaimed area Oostelijk Flevoland». Netherlands Journal of Zoology 18: 313-407. doi:10.1163/002829668x00027.
- ↑ «Peregrines at Derby Cathedral». Derbyshire Wildlife Trust, Derby Cathedral and Derby Museum & Art Gallery. Archivado desde el original el 2 de octubre de 2011. Consultado el 11 de abril de 2015
- ↑ Denny, Henry (1842). Monographia anoplurorum Britanniae or an essay on the British species of parasitic insects belonging to the order anoplura of leach. Londres: Henry G Bohn. p. 139.
- ↑ Clay, Theresa; Hopkins, G H E (1952). «The early literature on Mallophaga. Part 2. 1763–75». Bulletin of the British Museum (Natural History). Entomology 2: 1-42.
- ↑ Martyn, K P (1988). Provisional atlas of the ticks (Ixodoidea) of the British Isles. Grange-over-Sands, Cumbria: Institute of Terrestrial Ecology. p. 26. ISBN 1-870393-09-0.
- ↑ Hill, Dennis S (1962). «A study of the distribution and host preferences of three species Of Ornithomyia (Diptera: Hippoboscidae) in the British Isles». Proceedings of the Royal Entomological Society of London. Series A, General Entomology 37 (4–6): 37. doi:10.1111/j.1365-3032.1962.tb00286.x.
- ↑ Mižáková, A; Gronesová, P; Betáková, T (2008). «Monitoring of influenza viruses in waterfowl and terrestrial birds in eastern Slovakia». Acta virologica 52: 71-73. PMID 18459840.
- ↑ Fereidouni, S R; Aghakhan, M; Werner, O; Starick, E; Bozorghmehrifard, M H (2005). «Isolation and identification of avian influenza viruses from migratory birds in Iran». Veterinary Record 157 (17): 526. doi:10.1136/vr.157.17.526.
- ↑ Schwarzová, K; Betáková, T; Neméth, J; Mizáková, A (2006). «Detection of Borrelia burgdorferi sensu lato and Chlamydophila psittaci in throat and cloacal swabs from birds migrating through Slovakia». Folia Microbiologica 51 (6): 653-658. PMID 17455806. doi:10.1007/BF02931634. Archivado desde el original el 2 de octubre de 2011.
- ↑ Palma, Ricardo L; Jensen, Jens-Kjeld (2005). «Lice (Insecta: Phthiraptera) and their host associations in the Faroe Islands». Steenstrupia 29 (1): 49-73. Archivado desde el original el 3 de marzo de 2016. Consultado el 25 de mayo de 2015.
- ↑ Dronen, Norman O; Blend, Charles K (2007). «Ophthalmophagus bucephali n. sp. (Digenea: Cyclocoelidae) from the American Goldeneye, Bucephala clangula americana (Anatidae), from the Central Flyway of North America and a Checklist of Goldeneye Parasites». Comparative Parasitology 74 (1): 48-74. doi:10.1654/4221.1.
- ↑ Atyeo, Warren T; Peterson, Paul C (1976). «The feather mite genera Zumptia Gaud & Mouchet and Parazumptia gen. nov. (Acarina, Analgoidea)». Tijdschrift Voor Entomologie 119: 327-335. Archivado desde el original el 12 de agosto de 2011.
- ↑ Rasmussen, P C (2005). «Biogeographic and conservation implications of revised species limits and distributions of South Asian birds». Zoologische Mededelingen Leiden. 79-3 (13): 137-146.
- ↑ Gibbons, David Wingfield; Reid, James B; Chapman, Robert A (editors) (1993). The New Atlas of Breeding Birds in Britain and Ireland: 1988–91. Calton, Staffordshire: T & A D Poyser. pp. 146-147. ISBN 0-85661-075-5.
- ↑ Carpenè, E; Serra R; Isani G (1995). «Heavy metals in some species of waterfowl of northern Italy». Journal of Wildlife Diseases 31 (1): 49-56. PMID 7563424. doi:10.7589/0090-3558-31.1.49.
- ↑ Moore, N P; Roy, S S; Helyar, A (2003). «Mink (Mustela vison) eradication to protect ground-nesting birds in the Western Isles, Scotland, United Kingdom». New Zealand Journal of Zoology 30 (4): 443-452. doi:10.1080/03014223.2003.9518351.
- ↑ «Outer Hebrides Biosecurity Plan 2010–2015». Outer Hebrides Fisheries Trust. Archivado desde el original el 19 de enero de 2012. Consultado el 21 de abril de 2011
- ↑ «Consultation draft – March 2001». The natural heritage of the Western Isles. Scottish Natural Heritage. Archivado desde el original el 4 de mayo de 2004. Consultado el 25 de mayo de 2015. Retrieved 21 April 2011
- ↑ «American mink 'safe haven' project under way». BBC News Scotland, 12 May 2011 (BBC). 12 de mayo de 2011. Consultado el 12 de mayo de 2011
- ↑ Boev, Zlatovar (2006) "Gamefowl in Bulgaria over the last 8,000 years" pp. 398–389 in Botev, Nicola (ed) (1996). Proceedings of the 22nd Congress of the International Union of Game Biologists 1995: The game and the man. Sofia: Pensoft Publishers. ISBN 954-642-013-1.
- ↑ Allason-Jones, Lindsay (2005). Women in Roman Britain. York: Council for British Archaeology. p. 103. ISBN 1-902771-43-5.
- ↑ Grimm, Jessica M (2010) "A bird for all occasions. The use of birds at the Romano-British sanctuary of Springhead, Kent, UK" pp. 187–195 in Prummel, W; Zeiler, J T; Brinkhuizen, D C (2010). Birds in Archaeology: Proceedings of the 6th Meeting of the ICAZ Bird Working Group in Groningen 23.8–27.8.2008. Groningen Archaeological Studies, 12. Eelde: Barkhuis. ISBN 978-90-77922-77-4.
- ↑ Watson, George E (2002) "Birds: evidence from wall paintings sculpture, skeletal remains, and ancient authors" pp. 360,394 in Jashemski, Wilhelmina Mary Feemster; Meyer, Frederick Gustav (2002). The natural history of Pompeii. Cambridge: Cambridge University Press. ISBN 0-521-80054-4.
- ↑ Serjeantson, Dale 2006) "The consumption and supply of birds in Late Medieval England pp. 131–147 in Woolgar, C M; Serjeantson, Dale; Waldron, Tony (2006). Food in medieval England: diet and nutrition. Oxford: OUP. ISBN 0-19-927349-9.
Enlaces externos
editar- Wikimedia Commons alberga una categoría multimedia sobre Rallus aquaticus.
- Wikispecies tiene un artículo sobre Rallus aquaticus.
- Ficha de identificación de la especie (PDF) por Javier Blasco-Zumeta y Gerd-Michael Heinze.