Triclosán
El triclosán es un potente agente antibacteriano y fungicida. En condiciones normales se trata de un sólido incoloro con un ligero olor a fenol. En caso de ser ingerido, puede llegar a causar enfermedades graves, dependiendo la cantidad de la misma que entre a la boca.
| Triclosán | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
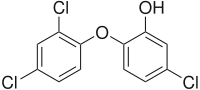
| 5-cloro-2-(2,4-diclorofenoxi)fenol | ||
| Identificadores | ||
| Número CAS | 3380-34-5 | |
| Código ATC | D08AE04 | |
| PubChem | 5564 | |
| Datos químicos | ||
| Fórmula | C12H7O2Cl3 | |
| Peso mol. | 289,54 g/mol | |
Aplicaciones
editarEl triclosán (2,4,4'-tricloro-2'-hidroxidifenil éter) es un antiséptico utilizado en productos hospitalarios (soluciones para lavado de manos quirúrgico, jabones para lavado de pacientes) y productos de consumo (desodorantes, dentífricos, colutorios). Su mecanismo de acción no es muy conocido.
El triclosán está presente en muchos productos como son cosméticos (jabones, desodorantes, pastas de dientes, enjuagues bucales, productos de primeros auxilios (vendas, tiritas, etc.), como agente desinfectante. Además, un número creciente de productos destinados al consumidor final están impregnados de triclosán como la ropa de cama, ropa (calcetines), alfombras, juguetes para bebés, bolsas de basura, menaje de cocina (cubiertos), equipamiento informático (teclados de ordenador, móviles), electrodomésticos, encimeras de cocina, etc.[1]
En el medio ambiente, el triclosán puede ser degradado por microorganismos o reaccionar con la luz del sol, lo que da lugar a compuestos como los clorofenoles.
Mecanismo de acción
editarEl triclosán difunde a través de la membrana citoplásmica bacteriana e interfiere su metabolismo lipídico.[2][3] En las dosis de uso normales actúa como un biocida, y en dosis menores tiene efecto bacteriostático.
Datos preclínicos
editarRecientes estudios in vitro han observado que el triclosán es, además, un potente inhibidor de la enzima enoil-ACP reductasa (NADH) (modulada por el gen FabI) de la Escherichia coli[4] ya que es similar a la estructura molecular del sustrato natural de dicha enzima.[5] Dicha enzima interviene en el metabolismo lipídico, lo que concuerda con el concepto clásico de su actividad.
Fan estudió en 2002 un mecanismo de acción del triclosán en estafilococo y demostró que la aparición de resistencias coincidía con los niveles de sobreproducción de FabI.[6] En un trabajo realizado con 31 aislamientos clínicos, todas las cepas que presentaban MICs elevadas (>0.016 micro g/ml) mostraban incrementos de entre 3 y 5 veces de los niveles de enoil-ACP reductasa (NADH) (FabI). Las cepas con MICs de triclosán entre 1 y 2 micro g/ml presentaban sobreexpresión de la forma F204C del gen FabI. Al haberse demostrado un mecanismo de acción específico, ha surgido el debate de si se podrían generar resistencias al triclosán, y de si estas resistencias podrían dar lugar a resistencias cruzadas. Teóricamente, este fenómeno podría producirse por la selección de mutantes del gen FabI.
La hipótesis de una única diana para el triclosán no ha sido todavía corroborada. Suller and Russell han investigado esta cuestión y han observado que otros mecanismos de acción (fuga de potasio de la membrana, activada por triclosán).[7] Estudiaron el efecto bactericida del triclosán frente a diferentes cepas de S. aureus, bajo distintas condiciones (no-crecimiento, crecimiento exponencial y fase estacionaria). Si realmente existiera una sola diana, sería esperable que la actividad bactericida del antiséptico fuera diferente en cada una de las fases (ya que en unas se produciría el gen responsable de modular la resistencia, y en otras no). Sin embargo, los autores observaron que el triclosán tenía el mismo efecto bactericida en todos los grupos. Asimismo, tras cultivar en laboratorio cepas sensibles a triclosán, durante un mes a concentraciones sub-MIC, observaron resistencias pero dichas resistencias no se correlacionaban con una resistencia a antibióticos, como sería lo lógico.
Datos clínicos
editarA pesar de todos estos datos pre-clínicos, la hipótesis de la resistencia debe probarse en pacientes para demostrar una conexión del uso de triclosán con la resistencia al triclosán y la resistencia a los antibióticos. Ni los datos clínicos ni epidemiológicos han demostrado dicha hipótesis.
Cole publicó en 2003 un estudio aleatorizado con 30 usuarios regulares de antisépticos de USA y UK (triclosán, para-cloro-meta-xilenol, aceite del pino y compuesto del amonio cuaternario) y 30 no usuarios (1.238 muestras). En 33 S. aureus aislados, ninguno mostró resistencia a oxacilina o a vancomicina; en 149 Enterococcus sp, ninguno era resistente a ampicillina o vancomicina; en 54 Klebsiella pneumoniae y 24 E. coli , ninguno era resistente a cefalosporinas de tercera generación. En general, la resistencia a los antibióticos habituales, fue similar en ambos grupos. La conclusión de los autores es que la hipótesis de resistencia cruzada no está fundada clínicamente.[8]
En el estudio de Suller y Russell[7] testaron la susceptibilidad de aislamientos clínicos a triclosán. Seleccionaron las que tenían MICs con rangos entre 0.00025 y 0,001 mg/mlL. Posteriormente probaron la sensibilidad de dichas bacterias a diversos antibióticos. Dichas cepas no presentaban más resistencias a antibióticos que la cepa original.
En un estudio observacional, Walker evaluó la eficacia y seguridad de un dentífrico que contenía triclosán. En este estudio aleatorizado, doble ciego, 144 pacientes utilizaron una solución que contenía triclosán, frente a otra que no contenía el antiséptico durante un periodo de 6 meses, y analizaron posteriormente le composición de microflora de la placa dental supragingival. Los pacientes del grupo de triclosán presentaban una reducción estadísticamente significativa de la flora cultivable a 3 y 6 meses, y no se reportó la aparición de ningún patógeno oportunista con una susceptibilidad reducida al triclosán.[9]
Webster et al. también evaluaron el uso de un gel hospitalario para lavado de manos que contenía triclosán, durante un brote MRSA en una UCI neonatal. Tras 12 meses de uso, el número total de aislamientos positivos a gram-negativos en dicho servicio no se incrementó, y sí se apreció una reducción del consumo de antibióticos. No se detectaron resistencias y el número total de infecciones nosocomiales se redujo (P<0.05).[10]
Sullivan publicó también un estudio acerca del impacto del triclosán en la flora oral. 9 voluntarios utilizaron dentífrico que contenía triclosán durante 14 días, tras los cuales se recogieron muestras de saliva. Se estudió la MIC del triclosán y la aparición de resistencias antibióticas de los gérmenes aislados en dicho periodo. No se apreciaron resistencias al antiséptico ni a los antibióticos testados.[11] Otros estudios similares realizados durante más de 6 meses han arrojado los mismos resultados.[12][13]
Riesgos medioambientales
editarUn estudio publicado en 2010 y realizado por científicos pertenecientes al Institut Català de Recerca de l'Aigua (ICRA), advierte sobre los posibles efectos tóxicos del triclosán y su persistencia en los sistemas fluviales, ya que el proceso de depuración de las plantas de tratamiento no puede eliminarlo.
Damià Barceló, director del ICRA y coautor del trabajo, explica en declaraciones a El Periódico de Catalunya que «el triclosán es un bactericida que está presente en la mayoría de pastas dentífricas, colutorios y desodorantes del mercado. Es un producto muy común, que las plantas de tratamiento no consiguen eliminar porque sobrevive a la depuración. Por eso es posible encontrarlo en gran parte de nuestros ríos y muy especialmente en el Ebro y el Llobregat».
El mismo autor añade que «la concentración de este producto inhibe la fotosíntesis de las algas de los ríos y con el tiempo los ecosistemas fluviales afectados pueden acabar muriéndose».[14]
El Comité Científico de Seguridad de los Consumidores (CCSC) de la Comisión Europea concluye que, hasta la fecha, no hay pruebas de que el uso del triclosán conduzca a un aumento de la resistencia a los antibióticos. Sin embargo, es demasiado pronto para afirmar que la exposición al triclosán no deriva en resistencia microbiana en ningún caso, ya que aún no se dispone de información suficiente para hacer un análisis de riesgos completo.[15]
Riesgos para la salud
editarExisten algunos datos sobre los posibles efectos negativos del triclosán sobre la salud humana y animal. El estudio de Veldhoen concluye que bajas dosis de triclosán actuaban como disruptores endocrinos en una especie de rana.[13] El hallazgo hace sospechar que pueda tener el mismo efecto en los seres humanos. No obstante, estos autores publicaron con posterioridad otro artículo en la misma revista matizando las afirmaciones vertidas en el primero.[16]
En otro estudio publicado por la revista Environmental Health Perspectives, Isaac Pessah, director del Children's Center for Environmental Health de la Universidad de California Davis, observó in vitro el efecto del triclosán sobre el cerebro. Halló que podía incrementar los niveles de calcio dentro de las neuronas y con ello, teóricamente, afectar el desarrollo mental. No obstante el propio Dr. Pessah indica, en las conclusiones del estudio, la necesidad de realizar estudios in vivo para confirmar los hallazgos.[17]
En España la cadena de supermercados vasca Eroski eliminó esta sustancia en los productos de sus marcas, junto con el Parabeno.
En un estudio in vitro de 2017,[18] los autores concluyen que el triclosan es un agente inductor de transición epitelio-mesénquima en la línea celular MCF-7 de carcinoma de mama (https://atcc.org/Products/All/HTB-22.aspx), causando un incremento en la capacidad migratoria e invasiva de estas células y que por lo tanto tendría el potencial de inducir comportamientos metastásicos en tumores que responden a estrógenos. Los autores también señalan que futuros estudios in vivo son necesarios para validar estos hallazgos in vitro.
En septiembre de 2016, la FDA estadounidense prohibió el triclosán junto con otros ingredientes antimicrobianos en productos de limpieza de venta libre, basándose en que es insuficiente la evidencia que demuestra la seguridad de su uso diario a largo plazo y sobre su eficacia en la reducción de enfermedades e infecciones.[19] Una publicación de la Universidad de Chile presentó una investigación en que señala que el triclosán provoca daños neuronales[20] que fue publicada en la revista Frontiers in Molecular Neuroscience.[21]
La declaración de Florencia sobre Triclosan y Triclocarban
editarLa declaración de Florencia (junio 2017) sobre triclosán y triclorocarban[19] documenta el consenso de más de 200 científicos y profesionales médicos sobre los peligros y la falta de beneficio demostrado del uso común del triclosan y triclocarban.
Las razones expuestas son las siguientes:
- El triclosán y el triclocarbán se usan como antimicrobianos, un tipo de químicos presente en más de 2000 productos incluyendo jabones, pastas dentales, detergentes, ropa, juguetes, alfombras, plásticos y pinturas. En productos de aseo personal como jabón de mano, no hay evidencia que el uso de triclosan o triclocarban mejoren la salud del paciente o cliente, o prevengan enfermedades.
- El triclosán y el triclocarbán que se usan en productos terminan en el ambiente y se los ha detectado en una amplia variedad de matrices alrededor del mundo.
- El triclosán y el triclocarbán persisten en el medio ambiente y son una fuente de compuestos tóxicos y carcinógenos, incluyendo dioxinas, cloroformo y anilinas cloradas.
- El triclosán se acumula y particiona la sangre humana y leche materna. El triclosán y el triclocarbán y sus productos de transformación y subproductos se bioacumulan en plantas acuáticas y animales.
- El triclosán y el triclocarbán tienen efectos perjudiciales sobre los organismos acuáticos.
- Los seres humanos están expuestos a triclosán y triclocarbán por contacto directo con productos de cuidado personal y de otras fuentes, incluyendo alimentos, agua potable y polvo. El Triclosan se ha detectado en la orina de la mayoría de seres humanos analizados.
- El triclosán y el triclocarbán son disruptores endócrinos y se asocian con impactos reproductivos y de desarrollo en estudios animales e in vitro. Las implicaciones potenciales para la reproducción y el desarrollo humanos son motivo de preocupación y merecen un mayor estudio.
- La epidemiología humana y los estudios en animales sugieren que la exposición al triclosán puede aumentar la sensibilidad a los alérgenos.
- El uso excesivo de triclosán puede contribuir a la resistencia a antibióticos/antimicrobianos y puede modificar el microbioma.
- Varias autoridades, incluyendo la FDA, han restringido el uso de triclosán y triclocarbán en ciertos tipos de jabones. Estos y otros productos químicos antimicrobianos generalmente no están restringidos en otros productos.
A su vez, se hacen las siguientes recomendaciones:
- Evitar el uso de triclosán, triclocarbán y otros químicos antimicrobianos excepto en casos donde brinden un beneficio en la salud basado en evidencias (por ejemplo, pasta dental recetada por un médico para tratar enfermedad de encías) y haya evidencia adecuada que demuestre su seguridad.
- Cuando los antimicrobianos sean necesarios, usar alternativas más seguras que no sean persistentes y no representen ningún riesgo para los seres humanos o los ecosistemas.
- Etiquetar todos los productos que contengan triclosán, triclocarban y otros antimicrobianos, incluso en los casos en que no se hagan declaraciones de salud.
- Evaluar la seguridad de los antimicrobianos y sus productos de transformación durante todo el ciclo de vida del producto, incluyendo la fabricación, el uso a largo plazo, la eliminación y la liberación ambiental.
Referencias
editar- ↑ «El triclosán, el jabón antibacteriano que causa efectos preocupantes en la salud».
- ↑ Singer H; Muller S; Tixier C; Pillonel L (2002). «Triclosan: occurrence and fate of a widely used biocide in the aquatic environment: field measurements in wastewater treatment plants, surface waters, and lake sediments». Environ Sci Technol 36 (23): 4998–5004.
- ↑ Jones, R. Jampani HB, Newman JL, Lee AS (2000). «Triclosan: A review of effectiveness and safety in health care settings». AJIC Am J Infect Control 28: 184-96.
- ↑ Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR (1999). «Guideline for Prevention of Surgical Site Infection». The Hospital Infection Control Practices Advisory Committee. Infect Control Hosp Epidemiol 20 (23): 247-280.
- ↑ Levy (1999). «Molecular basis of triclosan activity». Nature 398 (23): 383-384. doi:10.1038/18803.
- ↑ Fan F. (2002). «Defining and combating the mechanisms of triclosan resistance in clinical isolates of Staphylococcus aureus». Antimicrobial Agents & Chemotherapy 46 (11): 3343-7.
- ↑ a b Suller MT. Russell AD. (2000). «Triclosan and antibiotic resistance in Staphylococcus aureus». Journal of Antimicrobial Chemotherapy 46 (1): 11-8. PMID 10882683.
- ↑ Peter Gilbert, PhD. (2002). «Literature-Based Evaluation of the Potential Risks Associated with Impregnation of Medical Devices and Implants with Triclosan». Surgical Infections. 3 (Suppl) (1): S55-63. PMID 12573040.
- ↑ Walker C. (1994). «The effects of a 0,3% triclosan-containing dentifrice on the microbial composition of supragingival plaque». J Clin Periodontol 21: 334-341. doi:10.1111/j.1600-051X.1994.tb00722.x.
- ↑ Webster J. (1994). «Elimination of methicillin-resistant Staphylococcus aureus from a neonatal intensive care unit after hand washing with triclosan.». J Paediatr Child Health 30: 59-64.
- ↑ Sullivan (2003). «Will triclosan in toothpaste select for resistant oral streptococci?». Clinical Microbiology & Infection 9 (4): 306-9.
- ↑ Edmiston C. (2004). «Impact of Triclosan-Impregnated Suture on in vitro Adherence of Nosocomial Surgical Pathogens». Surgical Microbiology Research Laboratory – Medical College of Wisconsin, Milwaukee. AJIC 32 (3): E108. doi:10.1016/j.ajic.2004.04.160.
- ↑ a b Nik Veldhoen et al. (2006). «The bactericidal agent triclosan modulates thyroid hormone-associated gene expression and disrupts postembryonic anuran development». Aquatic Toxicology 80 (3): 217–227. doi:10.1016/j.aquatox.2006.08.010.
- ↑ «Un bactericida de las pastas de dientes daña el agua del Ebro y el Llobregat».
- ↑ «Triclosán y resistencia a los antibióticos». Resumen realizado por GreenFacts del informe del CCSC.
- ↑ Veldhoen,N. Skirrow, R.C. et al. (2007). «Corrigendum to “The bactericidal agent triclosan modulates thyroid hormone-associated gene expression and disrupts postembryonic anuran development». Aquat. Toxicol 83 (1): 84. Archivado desde el original el 30 de marzo de 2013. Consultado el 1 de noviembre de 2012.
- ↑ «In Vitro Biologic Activities of the Antimicrobials Triclocarban, Its Analogs, and Triclosan in Bioassay Screens: Receptor-Based Bioassay Screens». Environ Health Perspect 116 (9): 1203–1210. 2008. doi:10.1289/ehp.11200.
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/27902959
- ↑ a b «Environmental Health Perspectives – The Florence Statement on Triclosan and Triclocarban». ehp.niehs.nih.gov (en inglés). Consultado el 10 de julio de 2017.
- ↑ «Científicos chilenos descubren que antibacteriano presente en productos de limpieza genera daño neuronal». 10 de febrero de 2019. Consultado el 10 de febrero de 2019. «Un grupo de científicos chilenos descubrió que el triclosán, popular antibacteriano utilizado en diversos productos de limpieza cotidianos, sería tóxico y generaría daños cognitivos.»
- ↑ «Frontiers in Molecular Neuroscience». frontiersin.org (en inglés). 26 de noviembre de 2018. Consultado el 10 de febrero de 2019. «Triclosan, a widely used industrial and household agent, is present as an antiseptic ingredient in numerous products of everyday use, such as toothpaste, cosmetics, kitchenware, and toys.»