Voltamperometría cíclica
La voltamperometría cíclica ( CV ) es un tipo de medida electroquímica potenciodinámica . En un experimento de voltamperometría cíclica, el potencial del electrodo de trabajo aumenta linealmente en función del tiempo. A diferencia de la voltamperometría de barrido lineal, después de que se alcanza el potencial establecido en un experimento CV, el potencial del electrodo de trabajo aumenta en la dirección opuesta para volver al potencial inicial. Estos ciclos de rampas de potencial pueden repetirse tantas veces como sea necesario. La corriente en el electrodo de trabajo se grafica frente al voltaje aplicado (es decir, el potencial del electrodo de trabajo) para dar la traza del voltamperograma cíclico. La voltamperometría cíclica se utiliza generalmente para estudiar las propiedades electroquímicas de un analito en disolución[1][2][3] o de una molécula que se adsorbe en el electrodo.
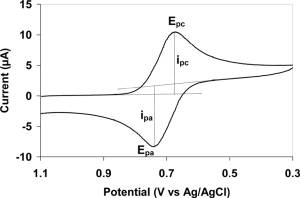

En la voltamperometría cíclica (CV), el potencial del electrodo aumenta linealmente en función del tiempo en las fases cíclicas (Figura 2). La velocidad de cambio de voltaje a lo largo del tiempo durante cada una de estas fases se conoce como velocidad de barrido del experimento (V/s). El potencial se mide entre el electrodo de trabajo y el electrodo de referencia, mientras que la corriente se mide entre el electrodo de trabajo y el contraelectrodo. Estos datos se representan como corriente ( i ) versus potencial aplicado (E, a menudo denominado simplemente 'potencial'). En la Figura 2, durante la exploración directa inicial (de t 0 a t 1) se aplica un potencial de reducción creciente; por tanto, la corriente catódica aumentará, al menos inicialmente, durante este período de tiempo, suponiendo que haya analitos reducibles en el sistema. En algún momento después de alcanzar el potencial de reducción del analito, la corriente catódica disminuirá a medida que se agote la concentración del analito reducible. Si el par redox es reversible, entonces durante el barrido inverso (de t 1 a t 2), el analito reducido comenzará a reoxidarse, dando lugar a una corriente de polaridad inversa (corriente anódica) a la anterior. Cuanto más reversible sea el par redox, más similar será la forma del pico de oxidación al pico de reducción. Por lo tanto, los datos de CV pueden proporcionar información sobre los potenciales redox y las velocidades de reacción electroquímica.
Por ejemplo, si la transferencia de electrones en la superficie del electrodo de trabajo es rápida y la corriente está limitada por la difusión de las especies de analitos a la superficie del electrodo, entonces la corriente máxima será proporcional a la raíz cuadrada de la velocidad de barrido. Esta relación se describe mediante la ecuación de Randles-Sevcik . En esta situación, el experimento CV solo toma muestras de una pequeña porción de la disolución, es decir, la capa de difusión en la superficie del electrodo.
Caracterización
editarLa utilidad de la voltamperometría cíclica depende en gran medida del analito que se esté estudiando. El analito tiene que ser oxidable o reducible dentro de la ventana de potencial escaneada.
El analito está en solución.
editarPares reversibles
editarA menudo, el analito muestra una onda CV reversible (como la que se muestra en la Figura 1), que se observa cuando todo el analito inicial se puede recuperar después de un ciclo de barrido hacia adelante y hacia atrás. Aunque estos pares reversibles son más simples de analizar, contienen menos información que las formas de onda más complejas.
La forma de onda incluso de los pares reversibles es compleja debido a los efectos combinados de polarización y difusión. La diferencia entre los dos potenciales de pico (E p), ΔE p, es de particular interés.
- Δ E p = E pa - E pc > 0
Esta diferencia se debe principalmente a los efectos de las velocidades de difusión del analito. En el caso ideal de un par reversible de 1e-, Δ E p es 57 mV y la mitad máxima del ancho del pico de barrido directo es de 59 mV. Los valores típicos observados experimentalmente son mayores, a menudo acercándose a 70 u 80 mV. La forma de onda también se ve afectada por la tasa de transferencia de electrones, generalmente referenciada como la barrera de activación para que se produzca la transferencia de electrones . Una descripción teórica del sobrepotencial de polarización se describe en parte mediante la ecuación de Butler-Volmer y las ecuaciones de la ecuación de Cottrell . En un sistema ideal las relaciones se reducen a para un proceso de n electrones[2].
Centrándonos en la corriente, los pares reversibles se caracterizan por ipa/ipc = 1.
Cuando se observa un pico reversible, se puede determinar la información termodinámica en forma de potencial de media celda E 0 1/2 . Cuando las ondas son semi-reversibles (ipa/ipc se acerca pero no es igual a 1), puede ser posible determinar información aún más específica (ver mecanismo de reacción electroquímica ).
Pares no reversibles
editarMuchos procesos redox observados por CV son quasireversibles o no reversibles. En tales casos, el potencial termodinámico E 01/2 a menudo se deduce mediante una simulación. La irreversibilidad está indicada por ipa/ipc ≠ 1. Las desviaciones de la unidad son atribuibles a una reacción química posterior que se desencadena por la transferencia de electrones. Dichos procesos de EC pueden ser complejos e involucrar isomerización, disociación, asociación, etc.[4]
El analito se adsorbe en la superficie del electrodo.
editarLas especies adsorbidas dan respuestas voltamperométricas simples: idealmente, a velocidades de barrido lentas, no hay separación de picos, el ancho del pico es de 90 mV para un par redox de un electrón, y la corriente máxima y el área del pico son proporcionales a la velocidad de barrido (observando que el pico la corriente es proporcional a la velocidad de barrido prueba que la especie redox que da el pico está realmente inmovilizada)[1]. El efecto de aumentar la velocidad de barrido se puede utilizar para medir la velocidad de transferencia de electrones interfacial y/o las velocidades de reacciones que están acopladas. Esta técnica ha sido útil para estudiar proteínas redox, algunas de las cuales se adsorben fácilmente en varios materiales de electrodos, ya que la teoría para moléculas redox biológicas y no biológicas es la misma (consulte la página sobre voltamperometría de película de proteínas ).
Configuración experimental
editarLos experimentos CV se llevan a cabo en una disolución en una celda equipada con electrodos. La disolución consiste en el disolvente, en el cual se disuelve el electrolito y las especies a estudiar[5].
La celda
editarUn experimento CV estándar emplea una celda equipada con tres electrodos: electrodo de referencia, electrodo de trabajo y contraelectrodo . Esta combinación a veces se denomina configuración de tres electrodos . Por lo general, se agrega electrolito a la disolución de muestra para garantizar una conductividad suficiente. La composición de disolvente, electrolito y material del electrodo de trabajo determinará el rango de potencial al que se puede acceder durante el experimento.
Los electrodos están inmóviles y se introducen en disoluciones sin agitación durante la voltamperometría cíclica. Este método de disolución "inmóvil" da lugar a picos controlados por difusión característicos de la voltamperometría cíclica. Este método también permite que una parte del analito permanezca después de la reducción u oxidación para que pueda mostrar más actividad redox. Es importante agitar la disolución entre las trazas de voltamperometría cíclica para suministrar analito fresco a la superficie del electrodo para cada nuevo experimento. La solubilidad de un analito puede cambiar drásticamente con su carga total; como tal, es común que las especies de analitos reducidos u oxidados se precipiten sobre el electrodo. Esta capa de analito puede aislar la superficie del electrodo, mostrar su propia actividad redox en escaneos posteriores o alterar la superficie del electrodo de una manera que afecte las mediciones de la CV. Por esta razón, a menudo es necesario limpiar los electrodos entre exploraciones.
Los materiales comunes para el electrodo de trabajo incluyen carbón vítreo, platino y oro . Estos electrodos generalmente están encerrados en una barra de aislante inerte con un disco expuesto en un extremo. Un electrodo de trabajo regular tiene un radio dentro de un orden de magnitud de 1 mm. Tener un área de superficie controlada con una forma bien definida es necesario para poder interpretar los resultados de la voltamperometría cíclica.
Para ejecutar experimentos de voltamperometría cíclica a velocidades de barrido muy altas, un electrodo de trabajo regular es insuficiente. Las altas tasas de barrido crean picos con grandes corrientes y mayores resistencias, lo que da como resultado distorsiones. Se pueden usar ultramicroelectrodos para minimizar la corriente y la resistencia.
El contraelectrodo, también conocido como electrodo auxiliar o segundo electrodo, puede ser cualquier material que conduzca la corriente con facilidad, no reaccione con el seno de la disolución y tenga un área de superficie mucho mayor que el electrodo de trabajo. Las opciones comunes son el platino y el grafito . Las reacciones que ocurren en la superficie del contraelectrodo no son importantes siempre que continúe conduciendo bien la corriente. Para mantener la corriente observada, el contraelectrodo a menudo oxidará o reducirá el disolvente o el electrolito.
Disolventes
editarLa CV se puede llevar a cabo utilizando una variedad de soluciones. La elección del did para la voltamperometría cíclica tiene en cuenta varios requisitos. El disolvente debe disolver el analito y altas concentraciones del electrolito de soporte. También debe ser estable en la ventana de potencial del experimento con respecto al electrodo de trabajo. No debe reaccionar ni con el analito ni con el electrolito de soporte. Debe ser puro para evitar interferencias.
Electrolito
editarEl electrolito garantiza una buena conductividad eléctrica y minimiza la caída de iR de modo que los potenciales registrados se correspondan con los potenciales reales. Para disoluciones acuosas, hay muchos electrolitos disponibles, pero los típicos son las sales de metales alcalinos de perclorato y nitrato. En disolventes no acuosos, el rango de electrolitos es más limitado y una opción popular es el hexafluorofosfato de tetrabutilamonio[6].
Técnicas potenciométricas relacionadas
editarTambién existen técnicas potenciodinámicas que agregan perturbaciones de CA de baja amplitud a una rampa potencial y miden la respuesta variable en una sola frecuencia (voltamperometría de CA) o en muchas frecuencias simultáneamente (espectroscopía de impedancia electroquímica potenciodinámica)[7]. La respuesta en corriente alterna es bidimensional, caracterizada tanto por la amplitud como por la fase . Estos datos se pueden analizar para determinar información sobre diferentes procesos químicos (transferencia de carga, difusión, carga de la doble capa, etc.). ). El análisis de respuesta de frecuencia permite el monitoreo simultáneo de los diversos procesos que contribuyen a la respuesta de CA potenciodinámica de un sistema electroquímico.
Mientras que la voltamperometría cíclica no es una voltamperometría hidrodinámica, sí lo son otros métodos electroquímicos útiles. En tales casos, el flujo se logra en la superficie del electrodo agitando la disolución, bombeando la disolución o girando el electrodo como es el caso de los electrodos de disco rotatorio y los electrodos de disco de anillo rotatorio . Tales técnicas se enfocan en condiciones estacionarias y producen formas de onda que parecen iguales cuando se escanean en direcciones positivas o negativas, limitándolas así a la voltamperometría de barrido lineal .
Aplicaciones
editarLa voltamperometría cíclica (CV) se ha convertido en una técnica electroanalítica importante y ampliamente utilizada en muchas áreas de la química. A menudo se utiliza para estudiar una variedad de procesos redox, para determinar la estabilidad de los productos de reacción, la presencia de intermediarios en las reacciones redox[8], la cinética de transferencia de electrones[9], y la reversibilidad de una reacción[10]. Se puede utilizar para la deposición electroquímica de películas delgadas o para determinar el rango de potencial de reducción adecuado de los iones presentes en el electrolito para realizar una deposición electroquímica[11]. La CV también se puede utilizar para determinar la estequiometría electrónica de un sistema, el coeficiente de difusión de un analito y el potencial de reducción formal de un analito, que se puede utilizar como herramienta de identificación. Además, debido a que la concentración es proporcional a la corriente en un sistema Nernstiano reversible, la concentración de una disolución desconocida se puede determinar generando una curva de calibración de corriente frente a concentración[12].
En biología celular se utiliza para medir las concentraciones[aclaración requerida] en organismos vivos[13]. En química organometálica, se utiliza para evaluar mecanismos redox[14].
Medición de la capacidad antioxidante
editarLa voltamperometría cíclica se puede utilizar para determinar la capacidad antioxidante en los alimentos e incluso en la piel[15][16]. Los antioxidantes de bajo peso molecular, moléculas que evitan que otras moléculas se oxiden actuando como agentes reductores, son importantes en las células vivas porque inhiben el daño celular o la muerte causada por reacciones de oxidación que producen radicales[17]. Los ejemplos de antioxidantes incluyen flavonoides, cuya actividad antioxidante aumenta considerablemente con más grupos hidroxilo[18]. Debido a que los métodos tradicionales para determinar la capacidad antioxidante implican pasos tediosos, se investigan continuamente técnicas para aumentar la velocidad del experimento. Una de estas técnicas implica la voltamperometría cíclica porque puede medir la capacidad antioxidante midiendo rápidamente el comportamiento redox en un sistema complejo sin necesidad de medir la capacidad antioxidante de cada componente[19][20]. Además, los antioxidantes se oxidan rápidamente en los electrodos inertes, por lo que el potencial de semiondao se puede utilizar para determinar la capacidad antioxidante[21]. Es importante tener en cuenta que siempre que se utiliza la voltamperometría cíclica, generalmente se compara con la espectrofotometría o la cromatografía líquida de alta resolución (HPLC)[22]. Las aplicaciones de la técnica se extienden a la química de los alimentos, donde se utiliza para determinar la actividad antioxidante del vino tinto, el chocolate y el lúpulo. Además, incluso tiene usos en el mundo de la medicina, ya que puede determinar los antioxidantes en la piel.
Evaluación de una técnica
editarLa técnica que se evalúa utiliza sensores voltamperométricos combinados en una lengua electrónica (ET) para observar la capacidad antioxidante en vinos tintos. Estas lenguas electrónicas (ET) consisten en múltiples unidades de detección como sensores voltamperométricos, que tendrán respuestas únicas a ciertos compuestos. Este enfoque es óptimo ya que las muestras de alta complejidad se pueden analizar con una alta selectividad cruzada. Por lo tanto, los sensores pueden ser sensibles al pH y a los antioxidantes. Como de costumbre, el voltaje en la celda se controla utilizando un electrodo de trabajo y un electrodo de referencia (electrodo de plata/cloruro de plata).[23]. Además, un contraelectrodo de platino permite que la corriente continúe fluyendo durante el experimento. El sensor de electrodos de pasta de carbón (CPE) y el electrodo compuesto de grafito-epoxi (GEC) se prueban en una solución salina antes de escanear el vino para que se pueda obtener una señal de referencia. Los vinos están entonces listos para ser escaneados, una vez con CPE y otra vez con GEC. Si bien la voltamperometría cíclica se utilizó con éxito para generar corrientes utilizando las muestras de vino, las señales eran complejas y necesitaban una etapa de extracción adicional[23]. Se encontró que el método ET podía analizar con éxito la capacidad antioxidante del vino, ya que coincidía con métodos tradicionales como los índices TEAC, Folin-Ciocalteu e I280[23]. Además, se redujo el tiempo, no fue necesario pretratar la muestra y no se necesitaron otros reactivos, todos ellos factores que disminuyen la popularidad de los métodos tradicionales[24]. Así, la voltamperometría cíclica determina con éxito la capacidad antioxidante e incluso mejora los resultados anteriores.
Capacidad antioxidante del chocolate y el lúpulo
editarLos antioxidantes fenólicos del cacao en polvo, el chocolate amargo y el chocolate con leche también se pueden determinar mediante voltamperometría cíclica. Para lograr esto, los picos anódicos se calculan y analizan sabiendo que el primer y tercer pico anódico pueden asignarse a la primera y segunda oxidación de los flavonoides, mientras que el segundo pico anódico representa a los ácidos fenólicos[20]. Utilizando el gráfico producido por voltamperometría cíclica, se puede deducir el contenido total de fenoles y flavonoides en cada una de las tres muestras. Se observó que el cacao en polvo y el chocolate negro tenían la mayor capacidad antioxidante ya que tenían un alto contenido de fenoles totales y flavonoides[20]. El chocolate con leche tenía la capacidad más baja ya que tenía el contenido más bajo de fenoles y flavonoides[20]. Si bien el contenido de antioxidantes se proporcionó utilizando los picos anódicos de voltamperometría cíclica, se debe usar HPLC para determinar la pureza de las catequinas y la procianidina en el cacao en polvo, el chocolate amargo y el chocolate con leche.
El lúpulo, las flores utilizadas en la elaboración de la cerveza, contiene propiedades antioxidantes debido a la presencia de flavonoides y otros compuestos polifenólicos[21]. En este experimento de voltamperometría cíclica, el voltaje del electrodo de trabajo se determinó utilizando un electrodo de referencia de ferricinio/ ferroceno . Al comparar diferentes muestras de extracto de lúpulo, se observó que la muestra que contenía polifenoles que se oxidaron a potenciales menos positivos demostró tener una mejor capacidad antioxidante[21].
Véase también
editar- Característica de corriente-voltaje
- Métodos electroanalíticos
- Voltamperometría cíclica de barrido rápido
- Ecuación de Randles-Sevcik
- Voltamperometría
Referencias
editar- ↑ a b Bard, Allen J.; Larry R. Faulkner (18 de diciembre de 2000). Electrochemical Methods: Fundamentals and Applications (2 edición). Wiley. ISBN 978-0-471-04372-0.
- ↑ a b Nicholson, R. S.; Irving. Shain (1 de abril de 1964). «Theory of Stationary Electrode Polarography. Single Scan and Cyclic Methods Applied to Reversible, Irreversible, and Kinetic Systems.». Analytical Chemistry 36 (4): 706-723. doi:10.1021/ac60210a007.
- ↑ Heinze, Jurgen (1984). «Cyclic Voltammetry-"Electrochemical Spectroscopy". New Analytical Methods (25)». Angewandte Chemie International Edition in English 23 (11): 831-847. doi:10.1002/anie.198408313.
- ↑ Savéant, Jean-Michel (2006), Elements of Molecular and Biomolecular Electrochemistry: An Electrochemical Approach to Electron Transfer Chemistry, John Wiley & Sons, p. 455, ISBN 978-0-471-44573-9, doi:10.1002/0471758078.
- ↑ Faulkner, L. R., "Understanding electrochemistry: Some distinctive concepts", Journal of Chemical Education 1983, 60, 262. doi 10.1021/ed060p262
- ↑ Geiger, W. E.; Barriere, F., "Organometallic Electrochemistry Based on Electrolytes Containing Weakly-Coordinating Fluoroarylborate Anions", Accounts of Chemical Research 2010, volume 43, pp. 1030-1039. doi 10.1021/ar1000023
- ↑ «Potentiodynamic Electrochemical Impedance Spectroscopy».
- ↑ Nicholson, R.S. (1965). «Theory and Application of Cyclic Voltammetry for Measurement of Electrode Reaction Kinetics». Anal. Chem. 37 (11): 1351-1355. doi:10.1021/ac60230a016.
- ↑ DuVall, Stacy DuVall; McCreery,Richard (1999). «Control of Catechol and Hydroquinone Electron-Transfer Kinetics on Native and Modified Glassy Carbon Electrodes». Anal. Chem. 71 (20): 4594-4602. doi:10.1021/ac990399d.
- ↑ Bond, Alan M.; Feldberg,Stephen (1998). «Analysis of Simulated Reversible Cyclic Voltammetric Responses for a Charged Redox Species in the Absence of Added Electrolyte». J. Phys. Chem. 102 (49): 9966-9974. doi:10.1021/jp9828437.
- ↑ Dev, Kapil; Kaur, Rajdeep; Vashisht, Garima; Sulania, Indra; Annapoorni, S. (2022). «Magnetization Reversal Behavior in Electrodeposited Fe-Co-Ni Thin Films». IEEE Transactions on Magnetics: 1. ISSN 0018-9464. doi:10.1109/TMAG.2022.3159562.
- ↑ Carriedo, Gabino (1988). «The use of cyclic voltammetry in the study of the chemistry of metal carbonyls». J. Chem. Educ. 65 (11): 1020. Bibcode:1988JChEd..65.1020C. doi:10.1021/ed065p1020.
- ↑ Wightman, R. Mark (2006). «Probing Cellular Chemistry in Biological Systems with Microelectrodes». Science 311 (5767): 1570-1574. Bibcode:2006Sci...311.1570W. PMID 16543451. doi:10.1126/science.1120027.
- ↑ Geiger, W. E., "Reflections on Future Directions in Organometallic Electrochemistry", Organometallics 2011, volume 30, pp. 28-31. doi 10.1021/om1010758
- ↑ Kohen, Ron, et.al. Overall low molecular weight antioxidant activity of biological fluids and tissues by cyclic voltammetry.Methods Enzymol. 1999;300:285-96.
- ↑ Chevion, Shlomit, and Mordechai Chevion. "Antioxidant status and human health: Use of cyclic voltammetry for the evaluation of the antioxidant capacity of plasma and of edible plants." Annals of the New York Academy of Sciences 899.1 (2000): 308-325.
- ↑ Sochor, Jiri, et al. "Electrochemistry as a tool for studying antioxidant properties." Int. J. Electrochem. Sci 8 (2013): 8464-8489.
- ↑ Firuzi, Omidreza, et al. "Evaluation of the antioxidant activity of flavonoids by “ferric reducing antioxidant power” assay and cyclic voltammetry." Biochimica et Biophysica Acta (BBA) - General Subjects 1721.1 (2005): 174-184.
- ↑ Kohen, R. Vellaichamy E, Hrbac J, Gati I, Tirosh O.Quantification of the overall reactive oxygen species scavenging capacity of biological fluids and tissues. Free Radic Biol Med. 2000 Mar 15;28(6):871-9.
- ↑ a b c d Brcanovic, Jelena M., et al. "Cyclic Voltammetric Determination of Antioxidant Capacity of Cocoa Powder, Dark Chocolate and Milk Chocolate Samples: Correlation with Spectrophotometric Assays and Individual Phenolic Compounds." Food Technology and Biotechnology 51.4 (2013): 460-470.
- ↑ a b c Masek, Anna, et al. "Characteristics of compounds in hops using cyclic voltammetry, UV–VIS, FTIR and GC–MS analysis." Food chemistry 156 (2014): 353-361.
- ↑ Martinez, Sanja, et al. "Cyclic voltammetry study of plasma antioxidant capacity–Comparison with the DPPH and TAS spectrophotometric methods."Journal of Electroanalytical Chemistry 588.1 (2006): 68-73.
- ↑ a b c Cetó, Xavi, et al. "Evaluation of red wines antioxidant capacity by means of a voltammetric e-tongue with an optimized sensor array." Electrochimica Acta120 (2014): 180-186.
- ↑ Arteaga, Jesús F., et al. "Comparison of the simple cyclic voltammetry (CV) and DPPH assays for the determination of antioxidant capacity of active principles." Molecules 17.5 (2012): 5126-5138.
Otras lecturas
editar- Bard, Allen J.; Larry R. Faulkner (18 de diciembre de 2000). Electrochemical Methods: Fundamentals and Applications (2 edición). Wiley. ISBN 978-0-471-04372-0.
- Zoski, Cynthia G. (7 de febrero de 2007). Handbook of Electrochemistry. Elsevier Science. ISBN 978-0-444-51958-0.
- Kissinger, Peter; William R. Heineman (23 de enero de 1996). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded (2 edición). CRC. ISBN 978-0-8247-9445-3.
- Gosser, David K. (20 de septiembre de 1993). Cyclic Voltammetry Simulation and Analysis of Reaction Mechanisms. VCH. ISBN 978-1-56081-026-1.
- Compton, Richard D.; Craig E. Banks (15 de noviembre de 2010). Understanding Voltammetry (2 edición). Imperial College Press. ISBN 978-1848165854.
Enlaces externos
editar- «CEM 372 Spring 2000 Cyclic voltammetry Lab Primer; Experiment 5: Cyclic Voltammetry». Michigan State University.
- Esta obra contiene una traducción derivada de «Cyclic voltammetry» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.

