Ácido acético
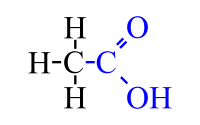
El ácido acético (también llamado ácido metilcarboxílico o ácido etanoico) puede encontrarse en forma de ion acetato. Se encuentra en el vinagre, y es el principal responsable de su sabor y olor agrios. Su fórmula es CH3-COOH (C2H4O2). De acuerdo con la IUPAC, se denomina sistemáticamente ácido etanoico.
| ácido acético | ||
|---|---|---|
 Estructura plana del ácido acético | ||
 Estructura tridimensional del ácido acético | ||
| Nombre IUPAC | ||
| ácido etanoico | ||
| General | ||
| Otros nombres | Ácido acético | |
| Fórmula semidesarrollada | CH3COOH | |
| Fórmula molecular | C2H4O2 | |
| Identificadores | ||
| Número CAS | 64-19-7[1] | |
| Número RTECS | AF1225000 | |
| ChEBI | 15366 | |
| ChEMBL | CHEMBL539 | |
| ChemSpider | 171 | |
| DrugBank | DB03166 | |
| PubChem | 176 | |
| UNII | Q40Q9N063P | |
| KEGG | D00010 | |
|
CC(O)=O
| ||
| Propiedades físicas | ||
| Apariencia | cristales | |
| Densidad | 1049 kg/m³; 1,049 g/cm³ | |
| Masa molar | 60,021129372 g/mol | |
| Punto de fusión | 290 K (17 °C) | |
| Punto de ebullición | 391,2 K (118 °C) | |
| Propiedades químicas | ||
| Acidez | 4,74 pKa | |
| Momento dipolar | 1,74 D | |
| Peligrosidad | ||
| SGA |
  | |
| NFPA 704 |
2
3
0
| |
| Frases H | H226, H314 | |
| Frases P | P280, P305+P351+P338, P310 | |
| Riesgos | ||
| Ingestión | Dolor de garganta, vómito, diarrea, dolor abdominal, sensación de quemazón en el tracto digestivo. | |
| Inhalación | Dolor de garganta, dificultad respiratoria, tos. | |
| Piel | Quemadura. | |
| Ojos | Irritación, visión borrosa, quemaduras profundas. | |
| Compuestos relacionados | ||
| Ácidos relacionados |
Ácido metanoico Ácido propílico Ácido butírico | |
| Compuestos relacionados |
Acetamida Acetato de etilo, Anhidrido acético, Acetonitrilo, Acetaldehído, Etanol, Cloruro de etanoilo | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Es el segundo ácido carboxílico más simple después del ácido fórmico o metanoico, que solo tiene un carbono, y antes del ácido propanoico, que ya tiene una cadena de tres carbonos.
El punto de fusión es 16,6 °C y el punto de ebullición es 117,9 °C. Es un líquido o cristal incoloro con sabor a ácido, vinagre, uno de los ácidos nucleicos más simples y un reactivo químico ampliamente utilizado.[2]
En disolución acuosa, puede perder el protón del grupo carboxilo para dar su base conjugada, el acetato. Su pKa es de 4,8 a 25 °C, lo cual significa, que al pH moderadamente ácido de 4,8, la mitad de sus moléculas se habrán desprendido del protón. Esto hace que sea un ácido débil y que, en concentraciones adecuadas, pueda formar disoluciones tampón con su base conjugada. La constante de disociación a 20 °C es Ka = 1,75·10−5.
Es de interés para la química orgánica como reactivo, para la química inorgánica como ligando, y para la bioquímica como metabolito (activado como acetil-coenzima A). También se utiliza como sustrato, en su forma activada, en reacciones catalizadas por las enzimas conocidas como acetiltransferasas y, en concreto, histona acetiltransferasas.
Hoy día, la vía natural de su obtención es a través de la carbonilación (reacción con CO) de metanol. Antaño se producía por oxidación de etileno en acetaldehído, el cual se oxidaba posteriormente para obtener, finalmente, el ácido acético.
Producción
editarEs producido por síntesis y por fermentación bacteriana. Hoy en día, la ruta biológica proporciona cerca del 10 % de la producción mundial, pero sigue siendo importante en la producción del vinagre, dado que las leyes mundiales de pureza de alimentos estipulan que el vinagre para uso en alimentos debe ser de origen biológico. Cerca del 75 % del ácido acético hecho en la industria química es preparada por carbonilación del metanol, explicada más adelante. Los métodos alternativos (como isomerización de formiato de etilo, conversión de gas de síntesis, oxidación de etileno y etanol) aportan el resto.[3][4]
En diferentes reacciones el ácido acético es un producto secundario. Por ejemplo, en la síntesis de ácido acrílico a partir de propano, propileno y acroleína, el ácido acético se produce también con selectividades entre 1 y 15%.[5][6] La producción fermentativa de ácido láctico produce también ácido acético.[7] La producción mundial total de ácido acético virgen se estima en 5 Mt/a (millones de toneladas por año), y aproximadamente la mitad es producida en los Estados Unidos. La producción de Europa es aproximadamente 1 Mt/a y está en descenso, y en Japón se producen 0,7 Mt/a. Otro 1,5 Mt se recicla cada año, lo que da, en el mercado mundial, un total de 6,5 Mt/a.[8][9] Los dos mayores productores de ácido acético virgen son Celanese y BP. Otros productores importantes son Millennium Chemicals, Sterling Chemicals, Samsung, Eastman Chemical Company y Svensk Etanolkemi.
Carbonilación del metanol
editarLa mayor parte del ácido acético se produce por carbonilación del metanol. En este proceso, el metanol y el monóxido de carbono reaccionan para producir ácido acético, de acuerdo a la ecuación química:
El proceso involucra al yodometano como un intermediario, y sucede en tres pasos. Se necesita un catalizador, generalmente un complejo metálico, para la carbonilación (etapa 2).
- (1)
- (2)
- (3)
Al modificar las condiciones del proceso, también puede producirse anhídrido acético en la misma planta. Debido a que tanto el metanol y el monóxido de carbono son materias brutas baratas, la carbonilación del metanol parecía ser un método atractivo para la producción de ácido acético.
Henry Dreyfus, en la compañía británica Celanese, desarrolló una planta piloto de carbonilación del metanol ya en 1925.[10] Sin embargo, la falta de materiales prácticos que pudieran contener la reacción corrosiva a la alta presión requerida (200 atm) desalentó la comercialización de estas rutas. El primer proceso comercial de carbonilación del metanol, que usaba un catalizador de cobalto, fue desarrollado por la compañía química alemana BASF en 1963.
En 1968, un catalizador basado en rodio (cis-[Rh (CO)2I2]- mostró que podría actuar eficientemente a menor temperatura, y con casi ningún subproducto. La primera planta en usar este catalizador fue construida por la compañía química norteamericana Monsanto en 1970, y la carbonilación del metanol catalizada por rodio se constituyó en el método dominante de producción de ácido acético (ver proceso Monsanto). En las postrimerías de los años 1990, las compañías químicas de BP comercializaron el catalizador del proceso Cativa (Ir (CO)2I2]−), que es promovido por el rutenio. Este proceso catalizado por iridio es más verde y más eficiente[11] y ha sustituido ampliamente al proceso Monsanto, frecuentemente en las mismas plantas de producción.
Oxidación del acetaldehído
editarAntes de la comercialización del proceso Monsanto, la mayor parte de ácido acético se producía por oxidación del acetaldehído. Este permanece como el segundo método más importante de fabricación, aunque no es competitivo con la carbonilación del metanol.
El acetaldehído puede ser producido por oxidación del butano o nafta ligera, o por hidratación del etileno. Cuando el butano o la nafta ligera son calentados con aire en la presencia de varios iones metálicos, incluyendo los de manganeso, cobalto y cromo; se forma el peróxido y luego se descompone para producir ácido acético según la ecuación química:
Generalmente, la reacción se lleva a cabo en una combinación de temperatura y presión diseñadas para ser lo más caliente posibles mientras se mantiene al butano en fase líquida. Unas condiciones de reacción típicas son 150 °C y 55 atm. Se pueden formar subproductos, que incluyen a la butanona, acetato de etilo, ácido fórmico y ácido propiónico. Estos subproductos también son de valor comercial, y las condiciones de reacción pueden ser modificadas para producir más de ellos si son económicamente útiles. Sin embargo, la separación de ácido acético de los subproductos agrega costo al proceso.
En condiciones similares y usando catalizadores similares a los usados para la oxidación del butano, el acetaldehído puede ser oxidado por el oxígeno en el aire para producir ácido acético
Usando catalizadores modernos, esta reacción puede tener un rendimiento de ácido acético superior al 95 %.
Los principales subproductos son el acetato de etilo, ácido fórmico y formaldehído, todos ellos con un punto de ebullición menor que el del ácido acético, y se pueden separar fácilmente por destilación.[12]
Oxidación del etileno
editarEl acetaldehído puede ser preparado a partir del etileno por medio del proceso Wacker, pero cabe mencionar que no puede ser oxidado. Más recientemente se ha comercializado una conversión del etileno a ácido acético más barata y en una sola etapa por la compañía química Showa Denko, que abrió una planta de oxidación de etileno en Ōita, Japón, en 1997.[13] El proceso está desencadenado por un catalizador metálico de paladio en un soporte de heteropoliácido, tal como el ácido tungstosilícico. Se cree que este método es competitivo con la carbonilación del metanol en plantas pequeñas (100–250 kt/a), dependiendo del precio local del etileno.
Fermentación oxidativa
editarDurante la mayor parte de la historia de la humanidad, el ácido acético, en la forma de vinagre, ha sido preparado por bacterias del género Acetobacter. En presencia de suficiente oxígeno, estas bacterias pueden producir vinagre a partir de una amplia variedad de alimentos alcohólicos. Algunos insumos comunes son la sidra, el vino, cereal fermentado, malta, arroz, o patatas. La reacción química general facilitada por estas bacterias es:
Una solución diluida de alcohol, inoculada con Acetobacter y mantenida en un lugar cálido y aireado se hará vinagre en el transcurso de algunos meses. Los métodos industriales de preparación de vinagre aceleran este proceso al mejorar el suministro de oxígeno a las bacterias.
Probablemente, la primera producción vinagre fue consecuencia de errores en la fermentación durante el proceso de elaboración de vino. Si el mosto se fermenta a temperatura demasiado alta, acetobacter dominará a la levadura presente naturalmente en las uvas.
Al aumentar la demanda de vinagre para fines culinarios, médicos y sanitarios, los productores de vinos aprendieron rápidamente a usar otros materiales orgánicos para producir vinagre en los meses cálidos de verano, antes que las uvas maduren y estén listas para ser procesadas en vino. Sin embargo, este método era lento y no siempre exitoso, y los productores de vino no entendían el proceso.
Uno de los primeros procesos comerciales modernos era el "método rápido" o "método alemán", practicado primero en Alemania en 1823. En este proceso, la fermentación tiene lugar en una torre empacada con virutas de madera o carbón. El insumo alcohólico es bombeado en la parte superior de la torre y aire fresco es suministrado desde la base, por convección natural o forzada. El suministro de aire mejorado en este proceso reduce el tiempo para preparar vinagre de meses a semanas.
La mayor parte del vinagre hoy en día es hecho en cultivo de tanque sumergido, descrito por primera vez en 1949 por Otto Hromatka y Heinrich Ebner. En este método, el alcohol se fermenta a vinagre en un tanque agitado continuamente, y se suministra oxígeno burbujeando aire a través de la solución. Usando aplicaciones modernas de este método, se puede preparar vinagre de 15 % ácido acético en solo 24 horas en un proceso por lotes, incluso de 20 % en 60 horas.
Fermentación anaeróbica
editarAlgunas especies de bacterias anaeróbicas, incluyendo miembros del género Clostridium, pueden convertir los azúcares en ácido acético directamente, sin usar etanol como intermediario. La reacción química total llevada a cabo por estas bacterias puede ser representada por:
Más interesante desde el punto de vista de un químico industrial es el hecho de que estos acetógenos pueden producir ácido acético a partir de compuestos de un carbono, incluyendo metanol, monóxido de carbono, o una mezcla de dióxido de carbono e hidrógeno:
Esta habilidad de Clostridium para utilizar los azúcares directamente, o para producir ácido acético de insumos menos costosos, significa que estas bacterias podrían producir ácido acético más eficientemente que los oxidadores de etanol como Acetobacter. Sin embargo, las bacterias Clostridium son menos tolerantes al ácido que las Acetobacter. Incluso las cepas de Clostridium más tolerantes al ácido solo pueden producir vinagre de muy baja concentración porcentual de ácido acético, comparado con cepas de Acetobacter que pueden producir vinagre de hasta 20 % ácido acético. En el presente, sigue siendo más efectivo en costo producir vinagre usando Acetobacter que producirlo usando Clostridium y luego concentrarlo. Como resultado, aunque las bacterias acetogénicas se conocen desde 1940, su uso industrial sigue estando confinado a unas pocas aplicaciones.
Aplicaciones y usos
editar- En apicultura, se utiliza para el control de las larvas y huevos de las polillas de la cera, enfermedad denominada galleriosis, que destruyen los panales de cera que las abejas melíferas obran para criar o acumular la miel.
- Sus aplicaciones en la industria química van muy ligadas a sus ésteres, como son el acetato de vinilo o el acetato de celulosa (base para la fabricación de nailon, rayón, celofán, etcétera).
- Son ampliamente conocidas sus propiedades como mordiente en soluciones fijadoras, para la preservación de tejidos (histología), donde actúa empíricamente como fijador de nucleoproteínas, y no así de proteínas plasmáticas, ya sean globulares o fibrosas. (Resultados avalados por J. Baker).
- En el revelado de fotografías en blanco y negro y de placas radiológicas, era y es utilizado en una solución muy débil como "baño de paro": al sumergirse en él el material revelado, se neutralizaba la alcalinidad del baño revelador y se detenía el proceso; posteriormente el baño fijador eliminaba el resto de material no revelado. Los fijadores a su vez, que utilizan mayoritariamente como componente principal el tiosulfato de sodio, incorporan el ácido acético como acidulante (fijador ácido) para mantener el pH de la solución lo suficientemente bajo en comparación con el del baño revelador.
- El acetato de celulosa por sus cualidades de transparencia y flexibilidad es también utilizado como uno de los materiales de base o soporte para la fabricación de películas cinematográficas y fotográficas sobre la que se aplica la emulsión fotosensible. También se empleó durante un tiempo como soporte o base para la fabricación de cinta magnetofónica, si bien para esta aplicación fue sustituido ventajosamente por el poliéster.
- Otros de sus usos en la medicina es como tinte en las colposcopias para detectar la infección por virus de papiloma humano, cuando el tejido del cérvix se tiñe de blanco con el ácido acético es positivo para infección de virus de papiloma humano, a esta tinción se le conoce como aceto blanco positivo.
También, mezclado con alcohol, es útil para la prevención de otitis externa.
- También sirve en la limpieza de manchas en general.
- Se usa también para usos de cocina como vinagre y también de limpieza.
Seguridad
editarEl ácido acético concentrado es corrosivo y, por tanto, debe ser manejado con cuidado apropiado, dado que puede causar quemaduras en la piel, daño permanente en los ojos, e irritación a las membranas mucosas. Estas quemaduras pueden no aparecer hasta horas después de la exposición. Los guantes de látex no ofrecen protección, así que deben usarse guantes especialmente resistentes, como los hechos de goma de nitrilo, cuando se maneja este compuesto.
El ácido acético concentrado se enciende con dificultad en el laboratorio. Hay riesgo de flamabilidad si la temperatura ambiente excede los 39 °C (102 °F), y puede formar mezclas explosivas con el aire sobre esta temperatura (límite de explosividad: 5,4 %-16 %).
Los peligros de las soluciones de ácido acético dependen de su concentración. La siguiente tabla lista la clasificación UE de soluciones de ácido acético:
Símbolo de seguridad
editar| Concentración por masa |
Molaridad (mol/L) |
Clasificación | Frases R |
|---|---|---|---|
| 10–25 | 1,67–4,16 | Irritante (Xi) | R36, R38 |
| 25–90 | 4,16–14,99 | Corrosivo (C) | R34 |
| >90 | >14,99 | Corrosivo (C) | R10, R35 |
Las soluciones de más de 25 % ácido acético se manejan en una campana de extracción de humos, debido al vapor corrosivo y pungente. El ácido acético diluido, en la forma de vinagre, es inocuo. Sin embargo, la ingestión de soluciones fuertes es peligrosa a la vida humana y animal en general. Puede causar daño severo al sistema digestivo, y ocasionar un cambio potencialmente letal en la acidez de la sangre.
Debido a incompatibilidades, se recomienda almacenar el ácido acético lejos del ácido crómico, etilenglicol, ácido nítrico y el ácido perclórico.
Véase también
editarReferencias
editar- ↑ Número CAS
- ↑ «Acetic acid».
- ↑ Yoneda, N.; Kusano, S.; Yasui, M.; Pujado, P.; Wilcher, S. (2001). «Recent advances in processes and catalysts for the production of acetic acid». Applied Catalysis A, General 221 (1-2): 253-265. doi:10.1016/S0926-860X(01)00800-6.
- ↑ «Processo de obtenção de ácido acético a partir de etanol». WO 2013053032 A1.
- ↑ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts. 2011. pp. 14-18; 77-100.
- ↑ «The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts». Journal of Catalysis (311): 369-385. 2014. doi:10.1016/j.jcat.2013.12.008. Archivado desde el original el 15 de febrero de 2016.
- ↑ «PRODUÇÕES DE ÁCIDO ACÉTICO, ETANOL E DOS ISÔMEROS ÓTICOS DO ÁCIDO LÁTICO POR LINHAGENS DE Lactobacillus ISOLADAS DE FERMENTAÇÕES ALCOÓLICAS INDUSTRIAIS». Ciênc. agrotec. 32: 503-509. 2008. Consultado el 2017.
- ↑ «Production report». Chem. Eng. News: pp. 67-76. 11 de julio de 2005.
- ↑ Suresh, Bala (2003), «Acetic Acid», Chemicals Economic Handbook, SRI International, p. 602.5000.
- ↑ Wagner, Frank S. (1978), «Acetic acid», en Grayson, Martin, ed., Kirk-Othmer Encyclopedia of Chemical Technology (3rd edition edición), New York: John Wiley & Sons.
- ↑ Lancaster, Mike (2002). Green Chemistry, an Introductory Text. Cambridge: Royal Society of Chemistry. pp. 262–66. ISBN 0-85404-620-8.
- ↑ «Acetic acid». National Institute of Standards and Technology. Consultado el 3 de febrero de 2008.
- ↑ Sano, Ken-ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou (1999). «A new process for acetic acid production by direct oxidation of ethylene». Catalyst Surveys from Japan 3. pp. 66-60. doi:10.1023/A:1019003230537.
Enlaces externos
editar- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del ácido acético.
