Reducción-oxidación
Se denomina reacción de reducción-oxidación (también, reacción de óxido-reducción o simplemente reacción rédox) a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.[1]
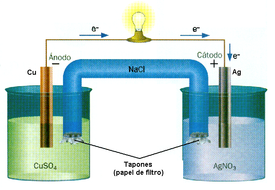

Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
- El agente oxidante es aquel elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
- El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.[2]
Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un «par rédox». Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par rédox con su precursor oxidado. Cuando una especie puede oxidarse, y a la vez reducirse, se le denomina anfolito, y al proceso de la oxidación-reducción de esta especie se le llama anfolización o dismutacion.
Principio de electroneutralidad
editarEl principio de electroneutralidad de Pauling corresponde a un método de aproximación para estimar la carga en moléculas o iones complejos; este principio supone que la carga siempre se distribuye en valores cercanos a 0 (es decir, -1, 0, +1).
Dentro de una reacción global rédox, se da una serie de reacciones particulares llamadas semirreacciones o reacciones parciales.
- Semirreacción de reducción:
- Semirreacción de oxidación:
o más comúnmente, también llamada ecuación general:
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica mediante el potencial de reducción, también llamado potencial rédox. Una titulación rédox es aquella en la que un indicador químico indica el cambio en el porcentaje de la reacción rédox mediante el viraje de color entre el oxidante y el reductor.
Oxidación
editarLa oxidación es una reacción química donde un elemento pierde electrones, y por lo tanto aumenta su estado de oxidación.[3] Se debe tener en cuenta que en realidad una oxidación o una reducción es un proceso por el cual cambia el estado de oxidación de un compuesto. Este cambio no significa necesariamente un intercambio de iones. Implica que todos los compuestos formados mediante un proceso redox son iónicos, puesto que es en estos compuestos donde sí se da un enlace iónico, producto de la transferencia de electrones. Por ejemplo, en la reacción de formación del cloruro de hidrógeno a partir de los gases dihidrógeno y dicloro, se da un proceso rédox y sin embargo se forma un compuesto covalente. Estas dos reacciones siempre se dan juntas; es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones rédox.
La vida misma es un fenómeno rédox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace), y sin embargo es muy electronegativo, casi tanto como el flúor. La sustancia más oxidante que existe es el catión KrF+
porque fácilmente forma Kr y F+
. Entre otras, existen el permanganato de potasio (KMnO
4), el dicromato de potasio (K
2Cr
2O
7), el agua oxigenada (H
2O
2), el ácido nítrico (HNO
3), los hipohalitos y los halatos (por ejemplo el hipoclorito de sodio (NaClO) muy oxidante en medio alcalino y el bromato de potasio (KBrO
3)). El ozono (O
3) es un oxidante muy enérgico:
El nombre de "oxidación" proviene de que, en la mayoría de estas reacciones, la transferencia de electrones se da mediante la adquisición de átomos de oxígeno (cesión de electrones) o viceversa. Sin embargo, la oxidación y la reducción puede darse sin que haya intercambio de oxígeno de por medio: por ejemplo, la oxidación de yoduro de sodio a yodo mediante la reducción de cloro a cloruro de sodio:
Ésta puede desglosarse en sus dos semirreacciones correspondientes:
- Semirreacción de reducción:
- Semirreacción de oxidación:
- Ejemplo
El hierro puede presentar dos formas oxidadas:
- Óxido de hierro (II): FeO.
- Óxido de hierro (III): Fe
2O
3.
Reducción
editarEn química, reducción es el proceso electroquímico por el cual un átomo o un ion gana electrones. Implica la disminución de su estado de oxidación. Este proceso es contrario al de oxidación.
Cuando un ion o un átomo se reduce presenta estas características:
- Actúa como agente oxidante.
- Es reducido por un agente reductor.
- Disminuye su estado o número de oxidación.
- Ejemplo
El ion hierro (III) puede ser reducido a hierro (II):
En química orgánica, la disminución de enlaces de átomos de oxígeno a átomos de carbono o el aumento de enlaces de hidrógeno a átomos de carbono se interpreta como una reducción. Por ejemplo:
Número de oxidación
editarLa cuantificación de un elemento químico puede efectuarse mediante su número de oxidación. Durante el proceso de oxidación, el número de oxidación o también llamado estado de oxidación del elemento aumenta. En cambio, durante la reducción, el número de oxidación de la especie que se reduce disminuye. El número de oxidación es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un enlace determinado. En un elemento puro todos los átomos son neutros, ya que estos no tienen carga y se les asigna el estado de oxidación 0.
El número de oxidación:
- Aumenta si el átomo pierde electrones (el elemento químico que se oxida), o los comparte con un átomo que tenga tendencia a captarlos.
- Disminuye cuando el átomo gana electrones (el elemento químico que se reduce), o los comparte con un átomo que tenga tendencia a cederlos.
Reglas para asignar el número de oxidación
editar- El número de oxidación de todos los elementos sin combinar es cero. Independientemente de la forma en que se representen dichos números.
- El número de oxidación de las especies iónicas monoatómicas coincide con la carga del ion.
- El número de oxidación del hidrógeno combinado es +1, excepto en los hidruros metálicos, donde su número de oxidación es –1 (ej: AlH
3, LiH). - El número de oxidación del oxígeno combinado es –2, excepto en los peróxidos, donde su número de oxidación es –1 (ej.:Na
2O
2, H
2O
2). - El número de oxidación en los elementos metálicos, cuando están combinados es siempre positivo y numéricamente igual a la carga del ion.
- El número de oxidación de los halógenos en los hidrácidos y sus respectivas sales es –1, en cambio el número de oxidación del azufre en su hidrácido y respectivas sales es –2.
- El número de oxidación de una molécula neutra es cero, por lo cual la suma de los números de oxidación de los átomos que constituyen a una molécula neutra es cero.
- La carga eléctrica total de una molécula no-neutra (no nula) se corresponde con la suma algebraica de los números de oxidación de todas las especies atómicas que la constituyen. ( ej: MnO−
4 = (1)*(+7) + (4)*(-2) = -1).
Ajuste de relaciones
editarTodo proceso rédox requiere del ajuste estequiométrico de los componentes de las semirreacciones para la oxidación y reducción.
Para reacciones en medio acuoso, generalmente se añaden:
- en medio ácido iones hidrógeno (H+
), moléculas de agua (H
2O), y electrones - en medio básico hidroxilos (OH−
), moléculas de agua (H
2O), y electrones para compensar los cambios en los números de oxidación.
Medio ácido
editarEn medio ácido se agregan hidronios (cationes) (H+
) y agua (H
2O) a las semirreacciones para balancear la ecuación final. Del lado de la ecuación que haga falta oxígeno se agregarán moléculas de agua, y del lado de la ecuación que hagan falta hidrógenos se agregarán hidronios. Por ejemplo, cuando el manganeso (II) reacciona con el bismutato de sodio.
Ecuación sin balancear:
- Oxidación :
- Reducción :
Ahora tenemos que agregar los hidronios y las moléculas de agua donde haga falta hidrógenos y donde haga falta oxígenos, respectivamente.
- Oxidación:
- Reducción:
Las reacciones se balancearán al momento de igualar la cantidad de electrones que intervienen en ambas semirreacciones. Esto se logrará multiplicando la reacción de una semirreacción por el número de electrones de la otra semirreacción (y, de ser necesario, viceversa), de modo que la cantidad de electrones sea constante.
- Oxidación:
- Reducción:
Al final tendremos:
- Oxidación:
- Reducción:
Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.
Medio básico
editarEn medio básico se agregan iones hidróxidos (aniones) (OH−
) y agua (H
2O) a las semirreacciones para balancear la ecuación final. Por ejemplo, tenemos la reacción entre el Permanganato de Potasio y el Sulfito de Sodio.
Ecuación sin balancear:
Separamos las semirreacciones en
- Oxidación:
- Reducción:
Agregamos la cantidad adecuada de Hidróxidos y Agua (las moléculas de agua se sitúan en donde hay mayor cantidad de oxígenos).
- Oxidación:
- Reducción:
Balanceamos la cantidad de electrones al igual que en el ejemplo anterior.
- Oxidación:
- Reducción:
Obtenemos:
- Oxidación:
- Reducción:
Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.
Aplicaciones
editarEn la industria, los procesos rédox también son muy importantes, tanto por su uso productivo (por ejemplo la reducción de minerales para la obtención del aluminio o del hierro) como por su prevención (por ejemplo en la corrosión). La reacción inversa de la reacción rédox (que produce energía) es la electrólisis, en la cual se aporta energía para disociar elementos de sus moléculas.
Oxidaciones y reducciones biológicas
editarEn el metabolismo de todos los seres vivos, los procesos rédox tienen una importancia capital, ya que están involucrados en la cadena de reacciones químicas de la fotosíntesis y de la respiración aeróbica. En ambas reacciones existe una cadena transportadora de electrones formada por una serie de complejos enzimáticos, entre los que destacan los citocromos; estos complejos enzimáticos aceptan (se reducen) y ceden (se oxidan) pares de electrones de una manera secuencial, de tal manera que el primero cede electrones al segundo, este al tercero, etc., hasta un aceptor final que se reduce definitivamente; durante su viaje, los electrones van liberando energía que se aprovecha para sintetizar enlaces de alta energía en forma de ATP.
Otro tipo de reacción rédox fundamental en los procesos metabólicos son las deshidrogenaciones, en las cuales una enzima(deshidrogenasa) arranca un par de átomos de hidrógeno a un sustrato; dado que el átomo de hidrógeno consta de un protón un electrón, dicho sustrato se oxida (ya que pierde electrones). Dichos electrones son captados por moléculas especializadas, principalmente las coenzimas NAD+
, NADP+
y FAD que al ganar electrones se reducen, y los conducen a las cadenas transportadoras de electrones antes mencionadas. El metabolismo implica cientos de reacciones rédox. Así, el catabolismo lo constituyen reacciones en que los sustratos se oxidan y las coenzimas se reducen. Por el contrario, las reacciones del anabolismo son reacciones en que los sustratos se reducen y las coenzimas se oxidan. En su conjunto, catabolismo y anabolismo constituyen el metabolismo.
Combustión
editarLa combustión es una reacción química de reducción-oxidación, en la cual generalmente se desprende una gran cantidad de energía, en forma de calor y luz, manifestándose visualmente como fuego. En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión (comburente), generalmente oxígeno en forma de O
2 gaseoso. Los explosivos tienen oxígeno ligado químicamente, por lo que no necesitan el oxígeno del aire para realizar la combustión. Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbono e hidrógeno ( ver hidrocarburos). En una reacción completa todos los elementos tienen el mayor estado de oxidación. Los productos que se forman son el dióxido de carbono (CO
2) y el agua, el dióxido de azufre (SO
2) (si el combustible contiene azufre) y pueden aparecer óxidos de nitrógeno (NO
x), dependiendo de la temperatura y la cantidad de oxígeno en la reacción.
Consecuencias
editarEn los metales una consecuencia muy importante de la oxidación es la corrosión, fenómeno de impacto estructural muy negativo, dado que los materiales adquieren o modifican sus propiedades según a los agentes que estén expuestos, y como actúen sobre ellos. Combinando las reacciones de oxidación-reducción (rédox) en una celda galvánica se consiguen las pilas electroquímicas. Estas reacciones pueden aprovecharse para evitar fenómenos de corrosión no deseados mediante la técnica del ánodo de sacrificio y para la obtención de corriente eléctrica continua.
Véase también
editar- Portal:Química. Contenido relacionado con Química.
- Culombimetría
- Electroquímica
- Pila Daniell
- Reacción irreversible y reacción reversible
- Reductor
- Oxidación orgánica
Referencias
editar- ↑ Burriel Martí, Fernando; Arribas Jimeno, Siro; Lucena Conde, Felipe; Hernández Méndez, Jesús (2007). Química analítica cualitativa. Editorial Paraninfo. p. 175. ISBN 9788497321402. Consultado el 2 de junio de 2012. «[...] también llamadas reacciones rédox, son aquéllas en las que cambia el estado o grado de oxidación de las especies reaccionantes; se produce un intercambio de electrones entre los reactivos.»
- ↑ Química para el nuevo milenio. (Octava edición). Escrito por John William Hill, Doris K Kolb. Página 204.
- ↑ Química: la ciencia central. Escrito por Theodore L. Brown,Bruce E. Bursten, Julia R. Burdge. Página 128.