Amidas metálicas
Las amidas metálicas (nombre sistemático aprobado por la IUPAC: azanidas metálicas) son una clase de compuestos de coordinación compuestos por un centro metálico con ligandos amida de la forma NR2−. Los complejos amido del ligando amido original NH2− son raros en comparación con los complejos con ligando diorganilamido, como el dimetilamido. Los ligandos de amida tienen dos pares de electrones disponibles para la unión.
-
Dímero de tris(dimetilamino)aluminio [1]
-
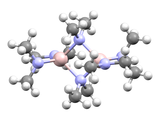
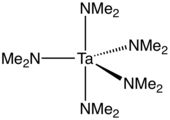
Pentakis(dimetilamido)tántalo
Geometría y estructura
editarEn principio, el grupo M-NX2 podría ser piramidal o planar. No se ha observado la geometría piramidal en este tipo de compuestos químicos todavía.
En muchos complejos, el amido es un ligando puente. Algunos ejemplos tienen ligandos amido tanto puente como terminales. Los ligandos de amida voluminosos tienen una menor tendencia a formar puentes. Los ligandos amida pueden participar en el enlace π metal-ligando dando un complejo en el que el centro metálico es coplanar con el nitrógeno y los sustituyentes. Las bis(trimetilsilil)amidas metálicas forman una subcategoría importante de compuestos de amida metálica. Estos compuestos tienden a ser discretos y solubles en disolventes orgánicos.
Amidas de metales alcalinos
editarLas amidas de litio son las amidas más importantes. Se preparan a partir de n-butillitio y la amina adecuada.
- R
2NH + BuLi → R
2NLi + BuH
Las amidas de litio son más comunes y más solubles que las amidas de los demás metales alcalinos. Las amidas de potasio se preparan por transmetalación de las amidas de litio con t-butóxido de potasio (véase también base de Schlosser) o por reacción de la amina con potasio, hidruro de potasio, n-butilpotasio o bencilpotasio.[2]
Las amidas de metales alcalinos, MNH2 (M = Li, Na, K) están disponibles comercialmente. La amida de sodio (también conocida como sodamida) se sintetiza a partir de sodio metálico y amoníaco con un catalizador de nitrato férrico.[3] El compuesto de sodio es blanco, pero la presencia de hierro metálico vuelve gris el material comercial.
- 2 Na + 2 NH3 → 2 NaNH2 + H2
La diisopropilamida de litio es una base no nucleófila popular utilizada en síntesis orgánica. A diferencia de muchas otras bases, el volumen estérico impide que esta base actúe como nucleófilo. Está disponible comercialmente, generalmente como solución en hexano. Se puede preparar fácilmente a partir de n-butillitio y diisopropilamina.
Principales complejos amido
editarLos derivados amido de los elementos del grupo principal están bien desarrollados.[4]
Complejos de metales de transición
editarLas amidas de metales de transición tempranas se pueden preparar tratando cloruro de metal anhidro con reactivos de amida alcalina. En algunos casos, se pueden utilizar dos equivalentes de una amina secundaria, uno de los cuales actúa como base:[5]
- MCln + n LiNR2 → M(NR2)n + n LiCl
- MCln + 2n HNR2 → M(NR2)n + n HNR2·HCl
Los complejos de amida de metales de transición se han preparado mediante estos métodos:[5]
- Tratamiento de un complejo de haluro con una amida alcalina
- desprotonación de una amina coordinada
- adición oxidativa de una amina
Complejos amido-amina
editarLos complejos de amina metálica altamente catiónicos como [Pt(NH3)6]4+ se convierten espontáneamente en el derivado amido:
- [Pt(NH3)6]4+ ↔ [Pt(NH3)5(NH2)]3+ + H+
Las amidas de metales de transición son intermediarios en la sustitución inducida por bases de los complejos de aminas de metales de transición . Por lo tanto, el mecanismo Sn1CB para el desplazamiento del cloruro del cloruro de cloropentamminocobalto por el hidróxido procede a través de un intermediario amido:[7]
- [Co(NH3)5Cl]2+ + OH − → [Co(NH3)4(NH2)]2+ + H2O + Cl−
- [Co(NH3)4NH2]2+ + H2O → [Co(NH3)5OH]2+
Véase también
editar- Imida inorgánica
Referencias
editar- ↑ Ouzounis, K.; Riffel, H.; Hess, H.; Kohler, U.; Weidlein, J. (1983). «Dimethylaminoalane, H3−nAl[N(CH3)2]n, n = 1, 2, 3 Kristallstrukturen und Molekülspektren». Zeitschrift für anorganische und allgemeine Chemie 504 (9): 67-76. doi:10.1002/zaac.19835040909.
- ↑ Michael Lappert, Andrey Protchenko, Philip Power, Alexandra Seeber (2009). «2. Alkali Metal Amides». Metal Amide Chemistry. John Wiley & Sons. ISBN 978-0-470-74037-8.
- ↑ Greenlee, K. W.; Henne, A. L.; Fernelius, W. Conard (1946). Sodium Amide. «Inorganic Syntheses». Inorg. Synth. 2. pp. 128-135. ISBN 978-0-470-13233-3. doi:10.1002/9780470132333.ch38.
- ↑ Waggoner, K.M.; Olmstead, M.M.; Power, P.P. (1990). «Structural and spectroscopic characterization of the compounds [Al(NMe2)3]2, [Ga(NMe2)3]2, [(Me2N)2Al{μ-N(H)1-Ad}]2 (1-Ad = 1-adamantanyl) and [{Me(μ-NPh2)Al}2NPh(μ-C6H4)]». Polyhedron 9 (2–3): 257-263. doi:10.1016/S0277-5387(00)80578-1.
- ↑ a b John F. Hartwig (2009). «4. Covalent (X-Type) Ligands Bound Through Metal-Heteroatom Bonds». Organotransition Metal Chemistry: From Bonding to Catalysis. University Science Books. ISBN 978-1-891389-53-5.
- ↑ Curley, J. J.; Cook, T. R.; Reece, S. Y.; Müller, P.; Cummins, C. C. (2008). «Shining Light on Dinitrogen Cleavage: Structural Features, Redox Chemistry, and Photochemistry of the Key Intermediate Bridging Dinitrogen Complex». Journal of the American Chemical Society 130 (29): 9394-9405. PMID 18576632. doi:10.1021/ja8002638.
- ↑ G. L. Miessler and D. A. Tarr "Inorganic Chemistry" 3rd Ed, Pearson/Prentice Hall publisher, ISBN 0-13-035471-6.