Benzotriazol
El benzotriazol (BTA) es un compuesto heterocíclico que contiene un anillo de benceno fusionado a un anillo de 1,2,3-triazol, con la fórmula química C6H5N3. Este compuesto aromático y polar es incoloro y se puede utilizar en diversos campos.
| Benzotriazol | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1H-Benzotriazol | ||
| General | ||
| Otros nombres | 1,2,3-Benzotriazol | |
| Fórmula estructural |
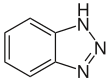 | |
| Fórmula molecular | C6H5N3 | |
| Identificadores | ||
| Número CAS | 95-14-7[1] | |
| ChEMBL | CHEMBL84963 | |
| Propiedades físicas | ||
| Apariencia | sólido blanco | |
| Densidad | 1360 kg/m³; 1,36 g/cm³ | |
| Masa molar | 119,12 g/mol | |
| Punto de fusión | 99[2] | |
| Punto de ebullición | 350 °C (623 K) | |
| Propiedades químicas | ||
| Acidez | 8,2[3][4] pKa | |
| Alcalinidad | 0,8 pKb | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Los benzotriazoles han sido conocidos por su gran versatilidad. Ya se utilizaron como un limitador en emulsiones fotográficas y como reactivo para la determinación analítica de plata. Más importante aún, se ha utilizado ampliamente como un inhibidor de la corrosión en el ambiente y bajo el agua. Por lo tanto, sus derivados y su eficacia como precursores de fármacos han estado atrayendo la atención. Además de todo de la aplicación se ha mencionado anteriormente, el benzotriazol se puede utilizar como anticongelante, sistemas de calefacción y refrigeración, fluidos hidráulicos e inhibidores de fase de vapor también.[5]
Estructura química
editarEl benzotriazol dispone de dos anillos fusionados. Su anillo de cinco miembros puede existir en 2 formas tautoméricas, la 1H y la 2H, que en disolución están en equilibrio:[5]
El benzotriazol tiene propiedades anfóteras, por lo que puede estar protonado en medio ácido o desprotonado en medio básico. Las constantes de disociación son pKa1= 0.42 y el pKa2= 8.27[6]
Síntesis
editarUna síntesis del benzotriazol implica la reacción de o-fenilendiamina, nitrito de sodio y ácido acético. Las conversión se produce mediante la obtención de una sal de diazonio en uno de los grupos amino de la orto-fenilendiamina (un benceno con dos grupos amino en posición orto):[7][8]
Aplicaciones
editarYa se han comentado anteriormente en la introducción las principales aplicaciones. Aquí se van a desarrollar someramente las principales:
Inhibidor de la corrosión
editarEl benzotriazol es un inhibidor de la corrosión eficaz para el cobre y sus aleaciones mediante la prevención de reacciones superficiales indeseables. Se sabe que se forma una capa pasiva, que consta de un complejo entre el cobre y el benzotriazol, cuando el cobre se sumerge en una solución que contiene benzotriazol. La capa pasiva es insoluble en disoluciones acuosas y muchas orgánicas. Existe una correlación positiva entre el espesor de la capa pasiva y la eficiencia de la prevención de la corrosión.[9][10] El BTA se utiliza en la conservación, en particular para el tratamiento de la enfermedad de bronce. La estructura exacta del complejo de cobre-BTA es controvertida y se han sugerido muchas propuestas.
Precursor de fármacos
editarLos derivados de benzotriazol tienen propiedades químicas y biológicas que son muy versátiles e interesantes para la industria farmacéutica. Algunos derivados de benzotriazol actúan como agonistas para muchas proteínas. Por ejemplo, el vorozol y la alizaprida tienen las propiedades inhibidoras contra diferentes proteínas.[11]
También se usa el benzotriazol para la síntesis de compuestos que pierden la estructura del sustrato de partida a lo largo de la reacción, como es el caso de la isocriptolepina:
Bibliografía
editar- ↑ Número CAS
- ↑ 1H-Benzotriazole, SRC PhysProp Database
- ↑ Katritzky, A. R.; Rachwal S.; Hitchings G. J. (14 de enero de 1991). «Benzotriazole: A novel synthetic auxiliary». Tetrahedron 47 (16–17): 2683-2732. doi:10.1016/S0040-4020(01)87080-0.
- ↑ Katritzky, A. R. «Adventures with Benzotriazole». Lecture presented at various locations in 2002. Florida Center for Heterocyclic CompoundsFor. Archivado desde el original el 26 de abril de 2012. Consultado el 23 de noviembre de 2011.
- ↑ a b Sease, Catherine (mayo de 1978). «Benzotriazole: A Review for Conservators». Studies in Conservation. 2 23 (2): 76-85. JSTOR 1505798. doi:10.2307/1505798.
- ↑ H. Wang, C. Burda, G. Persy, J. Wirz: Photochemistry of 1H-Benzotriazole in Aqueous Solution: A Photolatent Base in J. Am. Chem. Soc. 122 (2000) 5849–5855;doi 10.1021/ja994464c
- ↑ R. E. Damschroder and W. D. Peterson. (1955). «1,2,3-Benzotriazol». Organic Syntheses 3: 106. Archivado desde el original el 15 de enero de 2011. Consultado el 29 de julio de 2013.
- ↑ Robert A. Smiley “Phenylene- and Toluenediamines” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a19_405
- ↑ Finšgar, M.; Milošev, I. (11 de marzo de 2010). «Inhibition of copper corrosion by 1,2,3-benzotriazole: A review». Corrosion Science 52 (9): 2737-2749. doi:10.1016/j.corsci.2010.05.002.
- ↑ Nageh K. Allam; Ahmed Abdel Nazeer; Elsayed A. Ashour (2009). «A review of the effects of benzotriazole on the corrosion of copperand copper alloys in clean and polluted environments». J Appl Electrochem 39: 961-969. doi:10.1007/s10800-009-9779-4.
- ↑ Kale, Raju R.; Virendra Prasad; Prabhu P. Mohapatra; Vinod K. Tiwari (6 de marzo de 2010). «Recent developments in benzotriazole methodology for construction of pharmacologically important heterocyclic skeletons». Monatsh Chemistry 141 (11): 1159-1182. doi:10.1007/s00706-010-0378-1.