Compuesto organofluorado
Los compuestos organofluorados o compuestos de organoflúor son compuestos químicos orgánicos que contienen átomos de carbono y flúor unidos mediante enlaces covalentes fuertes y notablemente polarizados. Los compuestos organofluorados son muy diversos, y entre ellos podemos encontrar fluorocarbonos, compuestos perfluorados, o compuestos mono-fluorados sintetizados biológicamente, entre otras posibilidades. Estos compuestos tienen una amplia gama de funciones y puede servir como refrigerantes, productos farmacéuticos, agroquímicos y agentes tensioactivos aunque pueden resultar dañinos para la capa de ozono, y ser sustancias tóxicas o contaminantes.
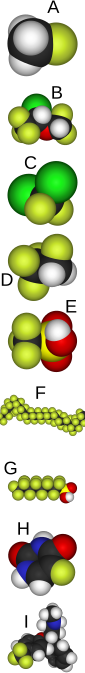
A: fluorometano
B: isoflurano
C: un CFC
D: un HFC
E: ácido tríflico
F: Teflón
G: PFOS
H: fluorouracilo
I: Prozac
La química de los compuestos órganofluorados comenzó su desarrollo a partir de la síntesis de gases refrigerantes realizada en 1928 por Thomas Midgley, continuando los trabajos de Frederic Swarts. Durante la Segunda Guerra Mundial se realizaron importantes avances que permitieron el desarrollo de algunos de estos compuestos como el teflón.[1]
Enlace
editarEl enlace carbono-flúor es conocido como el más fuerte en la química orgánica a causa de una mayor estabilidad por su carácter iónico parcial, que forma el enlace simple más fuerte con el carbono. El carácter iónico es el resultado de la electronegatividad del flúor (4,0), mucho mayor que la del carbono (2,5). Esta diferencia de electronegatividad induce cargas parciales sobre el carbono (positiva) y el flúor (negativa), lo que lleva a una atracción electrostática adicional, por lo que el enlace es corto y fuerte.
Compuestos
editarLos compuestos organofluorados que tienen el enlace carbono-flúor son de diversos tipos. Pueden ser fluorocarbonos, derivados de hidrocarburos fluorados, fármacos y agroquímicos fluorados, o compuestos monofluorados sintetizados biológicamente, entre otros. Los fluorocarbonos son compuestos que sólo contienen carbono y flúor,[2] mientras que los llamados perfluorocarbonos pueden contener enlaces a otros átomos.[3] Los productos farmacéuticos y agroquímicos habitualmente contienen sólo un átomo de flúor o un grupo trifluorometilo.[3] Sin embargo, algunos están más altamente fluorados, como el hexaflumuron que tiene seis átomos de flúor, y muchos de ellos poseen el grupo funcional tetrafluoroetoxi. Todos los organofluorados conocidos sintetizados biológicamente sólo contienen un enlace carbono-flúor[4]
Fluorocarbonos
editarLos fluorocarbonos son moléculas que sólo contienen carbono y flúor. Pueden ser gases, líquidos, ceras, o sólidos, dependiendo de su peso molecular. La forma más sencilla de fluorocarbono es el gas tetrafluorometano (CF4). Entre los líquidos se incluyen el perfluorooctano y la perfluorodecalina. El fluoropolímero politetrafluoretileno (PTFE/teflón) es un sólido. Mientras que los fluorocarbonos con enlaces simples son estables, los fluorocarbonos insaturados son más reactivos, especialmente aquellos con enlaces triples.
Compuestos perfluorados
editarLos compuestos perfluorados son derivados fluorados, que están estrechamente relacionados estructuralmente con los fluorocarbonos. Sin embargo, también poseen otros átomos distintos de carbono y flúor, tales como nitrógeno, yodo, o grupos iónicos, como por ejemplo los ácidos carboxílicos perfluorados.
Fluoruros de alquilo
editarLos monofluoruros alquilo contienen átomos de flúor unidos a radicales orgánicos, es decir se trata de hidrocarburos en los que el flúor ha sustituido algunos átomos de hidrógeno. Se pueden obtener a partir de alcoholes y el reactivo del Olah u otro agente de fluoración.
Propiedades
editarDebido al mayor o menor grado de fluoración de los compuestos organofluorados, sus propiedades son casi imposibles de comparar con el grupo. Cada vez que veas una molécula biológicamente activa que contiene flúor, podría estar ahí por una razón diferente, afirma el profesor de química William R. Dolbier Jr. de la Universidad de la Florida[5] Por el contrario, los compuestos a base de fluorocarbono son fluorados por razones químicas, físicas, y a veces por razones biológicas específicas, ya que tienen propiedades que son muy distintas a las de los hidrocarburos similares. Los organofluorados con un solo enlace carbono-flúor simplemente se comportan como un hidrocarburo. Por lo tanto, el único punto sobresaliente de todos los compuestos organofluorados es que el enlace carbono-flúor puede alterar las propiedades biológicas[6] Mientras que tanto el uracilo y el 5-fluorouracilo son sólidos cristalinos incoloros, con puntos de fusión elevados, el derivado organofluorado es un potente medicamento contra el cáncer. Del mismo modo, el fluoroacetato es un potente veneno natural, mientras que el ácido acético diluido en el agua es vinagre.
Papel biológico
editarSe han encontrado organofluorados biológicamente sintetizados en microorganismos y en plantas, pero no en animales.[4] El ejemplo más común es el fluoroacetato, que se presenta como defensa de las plantas contra los herbívoros en al menos 40 plantas de Australia, Brasil y África[7] Otros organofluorados de síntesis biológica son los ω-fluoroácidos grasoss, la fluoroacetona, y el 2-fluorocitrato que se cree que son biosintetizados en las vías bioquímicas del intermedio fluoroacetaldehido.[4] La adenosil-fluoruro sintasa es una enzima capaz de sintetizar biológicamente el enlace carbono-flúor.[8]
Los enlaces flúor-carbono producidos por el hombre se encuentran comúnmente en productos farmacéuticos y agroquímicos, ya que añade estabilidad a la estructura de carbono, también, el relativamente pequeño radio covalente del flúor es muy conveniente pues el flúor actúa como bioisóstero del grupo hidroxilo[9] La introducción del enlace carbono-flúor en los compuestos orgánicos es el mayor desafío para los químicos farmacéuticos dedicados a la química de organoflúor, pues el enlace carbono-flúor aumenta la probabilidad de tener una droga exitosa en alrededor de un factor de diez.[5] Se estima que el 20% de los productos farmacéuticos, y el 30-40% de los agroquímicos son organofluorados, incluyendo varios de los medicamentos más exitosos.[5] Entre los ejemplos se incluyen el 5-fluorouracilo, la fluoxetina (Prozac), la paroxetina (Paxil), el ciprofloxacino (Cipro), la mefloquina y el fluconazol
Efectos sobre el medio ambiente y la salud
editarAlgunos procesos abióticos también pueden generar compuestos organofluorados considerados como "moléculas problema". Ciertos fluorocarbonos con base de CFC y tetrafluorometano se han reportado en rocas ígneas y metamórficas.[4] Sin embargo, muchos organofluorados se enfrentan a problemas ambientales y de salud. Debido a la fuerza del enlace flúor-carbono, muchos fluorocarbonos sintéticos y compuestos con base de fluorocarbono son persistentes en el medio ambiente. Otros, como los CFC, participan en la destrucción del ozono. Los fluoroalcanos, comúnmente conocidos como perfluorocarbonos, son potentes gases de efecto invernadero. Los fluorosurfactantes PFOS y PFOA, y otros productos químicos relacionados, son contaminantes persistentes globales. El PFOS es un contaminante orgánico persistente y puede dañar la salud de la fauna. Los efectos potenciales para la salud de PFOA sobre los seres humanos están siendo investigados por el Grupo de Ciencia C8.
Véase también
editarEnlaces químicos del carbono con el resto de átomos
editar| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
editar- ↑ http://books.google.es/books?id=XvY_G4yUoacC&pg=PA12. Información Tecnológica. Vol. 8, Nº 3. Centro de Informacion Tecnologica, 1997. ISSN 0716-8756. Pág. 12
- ↑ Unión Internacional de Química Pura y Aplicada. «fluorocarbons». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ a b Lemal, D.M. (2004). «Perspective on Fluorocarbon Chemistry». J. Org. Chem. 69 (1): 1-11. PMID 14703372. doi:10.1021/jo0302556.
- ↑ a b c d Murphy CD, Schaffrath C, O'Hagan D.: "Fluorinated natural products: the biosynthesis of fluoroacetate and 4-fluorothreonine in Streptomyces cattleya" Chemosphere. 2003 Jul;52(2):455-61.
- ↑ a b c Thayer, Ann M. (5 de junio de 2006). «Fabulous Fluorine». Chemical & Engineering News 84 (23): 15-24. Consultado el 17 de enero de 2009.
- ↑ Hagmann, William K. (2008). «The Many Roles for Fluorine in Medicinal Chemistry». Journal of Medicinal Chemistry 51 (15): 4359-69. PMID 18570365. doi:10.1021/jm800219f.
- ↑ Proudfoot, Alex T; Bradberry, Sally M; Vale, J Allister (2006). «Sodium Fluoroacetate Poisoning». Toxicological Reviews 25 (4): 213-9. PMID 17288493. doi:10.2165/00139709-200625040-00002.
- ↑ O'Hagan, David; Schaffrath, Christoph; Cobb, Steven L.; Hamilton, John T. G.; Murphy, Cormac D. (2002). «Biochemistry: Biosynthesis of an organofluorine molecule». Nature 416 (6878): 279. doi:10.1038/416279a.
- ↑ Halocarbon: "Fluorine 101" Technical Archives. Accessed November 8, 2008.