Ácido glioxílico
El ácido glioxílico o ácido oxoacético es un compuesto orgánico que junto con el ácido acético, el ácido glicólico, y el ácido oxálico es uno de los ácidos carboxílicos C
2. Es un sólido incoloro común en la naturaleza que tiene una gran utilidad industrial.
| Ácido glioxílico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido oxoetanoico | ||
| General | ||
| Fórmula estructural |
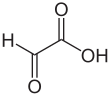 | |
| Fórmula molecular | C2H2O3 | |
| Identificadores | ||
| Número CAS | 298-12-4[1] | |
| ChEBI | 16891 | |
| ChEMBL | 1162545 | |
| ChemSpider | 740 | |
| DrugBank | DB04343 | |
| PubChem | 760 | |
| UNII | JQ39C92HH6 | |
| KEGG | C00048 | |
|
C(=O)C(=O)O
| ||
| Propiedades físicas | ||
| Masa molar | 74 g/mol | |
| Punto de fusión | 80 °C (353 K) | |
| Punto de ebullición | 111 °C (384 K) | |
| Propiedades químicas | ||
| Acidez | 3.18,[2] 3.32[3] pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura y nomenclatura
editarEl ácido glioxílico se describe usualmente con la fórmula química OCHCO
2H, como si contuviera un grupo funcional aldehído. De hecho la función aldehído no se observa en solución ni en la fase sólida.
Por lo general los aldehídos que poseen grupos sustituyentes que actúan como sumideros de electrones a menudo existen principalmente en sus formas hidrato. Por lo tanto la fórmula para el ácido glioxílico en realidad es (HO)
2CHCO
2H, descrita como "monohidrato."
Este diol existe en equilibrio con el hemiacetal dimérico en solución::[4] La constante para la ley de Henry del ácido glioxílico es KH = 1,09 × 104 × e [(40.0 × 103/R) × (1/T − 1/298)].[5]
2CHCO
2H O[(HO)CHCO
2H]
2 + H
2O
Preparación
editarEl compuesto se produce por la oxidación orgánica del glioxal con ácido nítrico, siendo el principal producto secundario el ácido oxálico. También resulta efectiva la ozonólisis del ácido maleico.[4]
La base conjugada del ácido glioxílico se conoce como glioxilato y es la forma predominante en que este compuesto existe en solución a pH neutro. El glioxilato es un intermediario del ciclo del glioxilato, el cual permite a algunos organismos tales como las bacterias,[6] hongos, y plantas[7] convertir ácidos grasos en carbohidratos. El glioxilato también es un subproducto de los procesos de amidación y desaminación biológicos.
Históricamente el ácido glioxílico ha sido preparado a partir del ácido oxálico por electrosíntesis:[8][9]
Reacciones y usos
editarEl ácido glioxílico es unas diez veces más ácido que el acético, con una constante de disociación ácida de 4,7 × 10−4 (pKa = 3,32):
2CHCOOH (HO)
2CHCO−
2 + H+
Con una base, el ácido glioxílico se desprotona según la reacción:
2O → HOCH
2COOH + HOOC–COOH
Incluso aunque el aldehído es un componente muy menor de sus soluciones (al igual que ocurre con las soluciones de formaldehído), el ácido glioxílico se comporta como un aldehído en algunas de sus reacciones. Por ejemplo, produce heterociclos luego de la condensación con urea y 1,2-diaminobenceno.
Derivados fenólicos
editarSu condensación con fenoles es muy versátil. El producto inmediato es el ácido 4-hidroximandélico. Esta especie reacciona con amoníaco para producir hidroxifenilglicina, un precursor de la amoxicilina. La reducción del ácido 4-hidroximandélico produce ácido 4-hidroxifenilacético, un precursor del atenolol. La condensación con guaiacol en lugar de fenol provee una ruta para la producción de vanilina, por medio de una formilación.[4][10][11]
Reacción de Hopkins Cole
editarEl ácido glioxílico es uno de los compuestos químicos utilizados en la Reacción Hopkins Cole, la cual se utiliza para determinar la presencia de triptófano en las proteínas.
Seguridad
editarEl compuesto no es demasiado tóxico. Para ratas su LD50 es de 2500 mg/kg.
Se ha mostrado que puede inducir sensibilización de la piel e irritación.[12]
Referencias
editar- ↑ Número CAS
- ↑ Dissociation Constants Of Organic Acids and Bases (600 compounds), http://zirchrom.com/organic.htm.
- ↑ pKa Data Compiled by R. Williams, «Copia archivada». Archivado desde el original el 2 de junio de 2010. Consultado el 2 de junio de 2010..
- ↑ a b c Georges Mattioda and Yani Christidis “Glyoxylic Acid” Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a12_495
- ↑ Ip, H. S. Simon; Huang, X. H. Hilda; Yu, Jian Zhen. «Effective Henry's law constants of glyoxal, glyoxylic acid, and glycolic acid». Geophysical Research Letters 36 (1). doi:10.1029/2008GL036212.
- ↑ Holms WH (1987). «Control of flux through the citric acid cycle and the glyoxylate bypass in Escherichia coli». Biochem Soc Symp. 54: 17-31. PMID 3332993.
- ↑ Escher CL, Widmer F (1997). «Lipid mobilization and gluconeogenesis in plants: do glyoxylate cycle enzyme activities constitute a real cycle? A hypothesis». Biol Chem. 378 (8): 803-813. PMID 9377475.
- ↑ Tafel, Julius; and Friedrichs, Gustav (1904). «Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung». Berichte der deutschen chemischen Gesellschaft 37 (3): 3187-3191. doi:10.1002/cber.190403703116. Consultado el 19 de diciembre de 2013.
- ↑ Cohen, Julius (1920). Practical Organic Chemistry 2nd Ed.. Londres: Macmillan and Co. Limited. pp. 102-104.
- ↑ Fatiadi, Alexander; and Schaffer, Robert (1974). «An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-"Vanillyl"-mandelic Acid, VMA)». Journal of Research of the National Bureau of Standards - A. Physics and Chemistry. 78A (3): 411-412. doi:10.6028/jres.078A.024. Consultado el 19 de diciembre de 2013.
- ↑ Kamlet, Jonas; and Mathieson, Olin (1953). Manufacture of vanillin and its homologues U.S. Patent 2,640,083. U.S. Patent Office.
- ↑ Anderson SE1, Ham JE, Munson AE. (2008). «Irritancy and Sensitization Potential of Glyoxylic Acid». J Immunotoxicol. 5(2):93-8. PMID 18569377. doi:10.1080/15476910802085681. Consultado el 14-9-16.