Glutatión reductasa
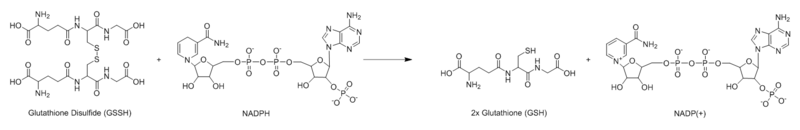
La glutatión reductasa (GR) conocida también como glutatión-disulfuro reductasa (GSR) es una enzima que en los seres humanos se encuentra codificada por el gen GSR. La glutatión reductasa (EC 1.8.1.7) cataliza la reducción del glutatión disulfuro (GSSG) para formar glutatión (GSH) en su forma sulfhidrilo, la cual es una molécula crítica para la resistencia al estrés oxidativo y para el mantenimiento del ambiente reductor en el interior de las células.[1][2][3] La glutatión reductasa funciona como una oxidorreductasa dimérica y utiliza FAD como grupo prostético y NADPH para reducir un equivalente molar de GSSG a dos equivalentes molares de GSH:
La enzima glutatión reductasa se encuentra conservada en todos los reinos de la biología. En bacterias, levaduras, y animales se encuentra un gen codificante para esta enzima, sin embargo, en los genomas de las plantas, se encuentran codificados dos genes. Curiosamente Drosophila y trypanosomas no poseen ninguna GR en absoluto.[4] En estos organismos, la reducción del glutatión es llevada a cabo ya sea por el sistema tiorredoxina o tripanotiona, respectivamente.[4][5]
Función
editar| Glutatión reductasa | ||||
|---|---|---|---|---|
|
Human GSR with bound glutathione and FADH | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.8.1.7 | |||
| Número CAS | 9001-48-3 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
El glutatión desempeña un rol clave en el mantenimiento de una función adecuada y en la prevención del estrés oxidativo en las células humanas. Este puede actuar como sumidero para los radicales hidroxilo, oxígeno singlete y varios electrófilos. El glutatión reducido reduce a la forma oxidada de la enzima glutatión peroxidasa, la cual a su vez reduce el peróxido de hidrógeno (H
2O
2), una especie química peligrosamente reactiva en el interior de la célula. Adicionalmente, desempeña un rol clave en el metabolismo y eliminación de xenobióticos, actuando como cofactor en varias enzimas detoxificantes, participa en el transporte, y regeneración de antioxidantes tales como la vitamina E y C a sus respectivas formas activas. La relación GSSG/GSH presente en el interior de la célula es un factor clave en el mantenimiento del adecuado balance oxidativo de la célula, esto es, es crítico que la célula mantenga niveles elevados de la forma reducida del glutatión y niveles bajos de la forma oxidada disulfuro de glutatión. Este ajustado balance se mantiene por la acción de la glutatión reductasa, la cual cataliza la reducción del GSSG a GSH.[1]
Estructura
editarLa glutatión reductasa de los eritrocitos humanos es una proteína dimérica consistente en dos monómeros de 52 Kd, cada uno de los cuales se encuentra formado por tres dominios. La GR exhibe una topología de lámina única doble capa donde una lámina beta antiparalela se encuentra ampliamente expuesta al solvente en una cara mientras se encuentra cubierta por hélices aleatorias en la otra cara.[6] Aquí se incluye un dominio de unión al NADPH, dominios de unión a FAD y un dominio de dimerización. Cada monómero contiene 478 residuos y una molécula de FAD. La GR es una proteína termoestable, reteniendo su función a temperaturas mayores a los 65.oC.[7][8]
Mecanismo de reacción
editarPasos:
| 1 | Unión del NADPH a la enzima oxidada |
| 2 | Reducción del FAD a anión FADH− por acción del NADPH |
| 3 | El anión reducido FADH− colapsa en un complejo de transferencia de carga y reduce al puente disulfuro Cys 58-Cys 63 |
| 4 | El disulfuro de glutatión oxidado se une a la enzima reducida y forma un disulfuro mixto con Cys 58 y libera una molécula de glutatión reducido |
| 5 | El residuo Cys 63 ataca al disulfuro mixto en Cys 58 para liberar una molécula más de glutatión reducido regenerando el puente disulfuro activo |
Semimecanismo reductivo
editarLa acción de la GSR procede a través de dos semimecanismos, un semimecanismo reductivo seguido de un semimecanismo oxidativo. En el primer semimecanismo, el NADPH reduce al FAD prostético presente en la GSR para producir un anión FADH−
fugaz. Este anión rápidamente rompe el puente disulfuro presente entre Cys
58-Cys
63, formando a través de un enlace covalente de corta vida un complejo de transferencia de carga estable entre la flavina y Cys
63. A continuación se libera el recientemente oxidado NADP+
y es reemplazado por una nueva molécula de NADPH, terminando de esta forma la mitad reductiva de este mecanismo.
Semimecanismo oxidativo
editarEn la mitad oxidativa del mecanismo, el residuo Cys
63 efectúa un ataque nucleofílico sobre la unidad sulfuro más cercana presente en la molécula de GSSG (acción promovida por His
467, la cual crea un puente disulfuro mixto (GS-Cys
58) y un anión GS−
. El residuo His
467 del GSR a conotinuación protona el anión GS−
para liberar la primera molécula de GSH. A continuación, Cys
63 realiza un ataque nucleofílico sobre Cys
58, liberando un anión GS−
, el cual toma un protón desde el solvente y se libera de la enzima en forma de una segunda molécula de GSH. De esta forma por cada molécula de GSSG y NADPH, se liberan dos moléculas de GSH, las cuales pueden actuar como sumideros antioxidantes para las especies reactivas de oxígeno dentro de la célula.[9]
Inhibición
editarLa glutatión reductasa es inhibida in vitro por concentraciones bajas de arsenito de sodio y los metabolitos metilados de arsenato, pero in vivo solo se han conseguido inhibiciones significativas a niveles de 10 mg/kg/día.[10] La glutatión reductasa además resulta inhibida por algunos flavonoides, una clase de pigmentos producidos por las plantas.[11]
Importancia clínica
editarEl glutatión es un antioxidante clave en la célula y desempeña un rol de mayor importancia en la fase 2 de la eliminación metabólica de xenobióticos electrofílicos. La importancia de la vía del glutatión y las enzimas que afectan a su delicado balance ha ganado la mayor atención en los últimos años. Aunque la glutatión reductasa ha parecido una diana atractiva para la acción de diversos fármacos, no hay hasta la fecha ningún compuesto terapéutico que haga diana sobre ella. En particular, la glutatión reductasa pareciera ser una buena diana terapéutica para la acción de antimaláricos, ya que la glutatión reductasa del parásito Plasmodium falciparum es significativamente diferente en cuanto a estructura y plegamiento a la glutatión reductasa de los mamíferos.[12] Al diseñar fármacos específicos para actuar sobre P. falciparum sería teóricamente posible inducir un estrés oxidativo selectivo sobre el parásito, sin afectar al hospedero.
Hay dos tipos principales de compuestos que hacen diana sobre la GSR:[13][14][15][16]
- Inhibidores de la dimerización o del enlace GSSG: Electrófilos reactivos tales como los compuestos de oro y fluoronaftoquinonas.
- Drogas que emplean a la propia glutatión reductasa para regenerarse, actuando como competidores redox. Dos ejemplos de este tipo de compuestos son el azul de metileno y las naftoquinonas.
Algunos ensayos clínicos llevados a cabo en Burkina Faso han mostrado resultados dispares al tratar a la malaria con naftoquinonas.
En células expuestas a altos niveles de estrés oxidativo, tales como los eritrocitos, más del 10% del consumo de glucosa se encuentra dirigido a la vía de las pentosas fosfato (PPP) para la producción del NADPH necesario para esta reacción. En el caso de los eritrocitos, si la vía de las pentosas se encuentra inhibida o resulta no funcional, el estrés oxidativo conduce a la lisis celular y a la consecuente anemia.[17]
El lupus es una enfermedad autoinmune en la cual los pacientes producen una cantidad muy elevada de anticuerpos que atacan el ADN y otros componentes celulares. En un reciente estudio, se ha encontrado que existe una alta asociación entre un polimorfismo de nucleótido simple en el gen de la glutatión reductasa de afroamericanos y el lupus.[18] Los afroamericanos con lupus también han demostrado tener niveles reducidos de glutatión en sus linfocitos T.[19] Los autores del estudio piensan que estos niveles reducidos en la actividad de la glutatión reductasa pueden contribuir a un aumento en los niveles de especies reactivas de oxígeno en afroamericanos con lupus.[18]
En ratones se ha implicado a la glutatión reductasa con el proceso de estallido oxidativo, un componente de la respuesta inmune.[20] El estallido oxidativo es un mecanismo de defensa por el cual los neutrófilos producen y liberan especies oxidantes y reactivas en la vecindad de bacterias u hongos para destruir a las células invasoras. Los neutrófilos con deficiencias de glutatión reductasa han demostrado producir un estallido oxidativo más fugaz y por lo tanto menos efectivo en respuesta a las bacterias que los neutrófilos que expresan a la GSR a niveles ordinarios.[20] El mecanismo por el cual la glutatión reductasa es capaz de sostener el estallido oxidativo por el momento permanece desconocido.[20]
Deficiencia
editarLa deficiencia de la glutatión reductasa es una enfermedad reara en la cual la actividad de la glutatión reductasa se encuentra ausente en los eritrocitos, leucocitos, o en ambos. En un estudio de esta enfermedad se observaron solo dos casos en 15000 ensayos para la deficiencia en la glutatión reductasa realizados a lo largo de 30 años.[21] En el mismo estudio, la deficiencia de gutatión reductasa fue relacionada en un paciente y su familia con cataratas y fabismo, y con severa hiperbilirrubinemia en otro paciente.[21] Se ha propuesto que el sistema redox glutatión, del cual la glutatión reductasa forma parte, es responsable casi por completo de la protección de los cristalinos contra el peróxido de hidrógeno, porque estas células son deficientes en catalasa, una enzima que cataliza la descomposición del peróxido de hidrógeno. Esto explicaría la alta incidencia de cataratas en individuos con deficiencias de la glutatión reductasa.[22]
Algunos pacientes muestran niveles deficientes de actividad glutatión reductasa como resultado de no consumir suficiente cantidad de riboflavina en sus dietas. La riboflavina es un precursor del FAD, cuya forma reducida es la que dona dos electrones al enlace disulfuro que se encuentra presente en la forma oxidada de la enzima glutatión reductasa, comenzando de esta forma el ciclo catalítico de la enzima. En 1999, un estudio encontró que el 17,8% de los varones y el 22,4% de las mujeres de Arabia Saudí sufren de niveles bajos de actividad de la glutatión reductasa como consecuencia de la deficiencia de riboflavina.[23]
Conexión con el fabismo
editarEn el fabismo, los pacientes carecen o presentan una actividad muy disminuida de la enzima glucosa-6-fosfato deshidrogenasa, una enzima que participa en la vía de las pentosas fosfato, la cual reduce al NAD+
para formar NADH mientras cataliza la conversión de glucosa-6-fosfato a 6-fosfoglucono-δ-lactona. Los individuos con una deficiencia de glucosa-6-fosfato deshidrogenasa poseen menos NADPH disponible para la reducción del glutatión oxidado por medio de la glutatión reductasa. Por lo tanto su relación basal entre la forma oxidada y reducida del glutatión es significativamente más alta que la de otros pacientes que expresan a la glucosa-6-fosfato deshidrogenasa a niveles normales, haciéndolos incapaces de responder efectivamente a niveles elevados de especies reactivas de oxígeno, lo cual causa la lisis celular.[24]
Monitoreo de la actividad de la glutatión reductasa
editarLa actividad de la glutatión reductasa se utiliza como indicador del estrés oxidativo. La actividad de esta enzima puede monitorearse por medio del consumo de NADPH, con un pico de absorbancia a 340 nm, o por la formación de GSH que puede visualizarse por medio del reactivo de Ellman.[25] Alternativamente la actividad puede medirse por medio de roGFP (redox-sensitive Green Fluorescent Protein es decir proteína verde fluorescente sensible al estado redox).[26]
En las plantas
editarDe la misma forma que ocurre en las células humanas, la glutatión reductasa ayuda a proteger a las células vegetales de las especies reactivas de oxígeno. En las plantas, el glutatión reducido participa en el ciclo del glutatión-ascorbato en el cual el glutatión reduce al deshidroascorbato, un subproducto de la reducción del peróxido de hidrógeno. En particular, la glutatión reductasa contribuye a la respuesta de las plantas contra el estrés abiótico.[27] La actividad de la enzima ha mostrado modularse en respuesta al estrés por metales, metaloides, salinidad, radiación ultravioleta, sequedad y calor.[27]
Historia
editarLa glutatión reductasa fue purificada por primera vez en 1955 en la Universidad de Yale por E. Racker.[28] Racker también identificó al NADPH cono el donante primario de electrones para esta enzima. Grupos posteriores confirmaron la presencia de FAD y del grupo tiol, y se sugirió un mecanismo por primera vez en 1965.[29][30] La primera estructura de baja resolución de la glutatión reductasa fue resuelta en 1977. Esta fue rápidamente sucedida por una estructura con una resolución de 3Å por Shulze et al. en 1978.[31] La glutatión reductasa ha sido exhaustivamente estudiada desde aquellos tempranos experimentos, y es por lo tanto, una de las enzimas más estudiadas hasta la fecha..
Mapa interactivo de la vía
editarSe puede encontrar un mapa interactivo de la vía donde participa la glutatión reductasa aquí:
Referencias
editar- ↑ a b Deponte M (mayo de 2013). «Glutathione catalysis and the reaction mechanisms of glutathione-dependent enzymes». Biochim. Biophys. Acta 1830 (5): 3217-66. PMID 23036594. doi:10.1016/j.bbagen.2012.09.018.
- ↑ Meister A (noviembre de 1988). «Glutathione metabolism and its selective modification». J. Biol. Chem. 263 (33): 17205-8. PMID 3053703.
- ↑ Mannervik B (August 1987). «The enzymes of glutathione metabolism: an overview». Biochem. Soc. Trans. 15 (4): 717-8. PMID 3315772.
- ↑ a b Kanzok SM, Fechner A, Bauer H, Ulschmid JK, Müller HM, Botella-Munoz J, Schneuwly S, Schirmer R, Becker K (2001). «Substitution of the thioredoxin system for glutathione reductase in Drosophila melanogaster». Science 291 (5504): 643-6. PMID 11158675. doi:10.1126/science.291.5504.643.
- ↑ Krauth-Siegel RL, Comini MA (2008). «Redox control in trypanosomatids, parasitic protozoa with trypanothione-based thiol metabolism». Biochim Biophys Acta 1780 (11): 1236-48. PMID 18395526. doi:10.1016/j.bbagen.2008.03.006.
- ↑ Grisham,, Reginald H. Garrett,... Charles M. (2005). Biochemistry (3rd edición). Belmont, CA: Thomson Brooks/Cole. ISBN 0534490336.
- ↑ Masella R, Di Benedetto R, Varì R, Filesi C, Giovannini C (October 2005). «Novel mechanisms of natural antioxidant compounds in biological systems: involvement of glutathione and glutathione-related enzymes». J. Nutr. Biochem. 16 (10): 577-86. PMID 16111877. doi:10.1016/j.jnutbio.2005.05.013.
- ↑ Dym O, Eisenberg D (septiembre de 2001). «Sequence-structure analysis of FAD-containing proteins». Protein Sci. 10 (9): 1712-28. PMC 2253189. PMID 11514662. doi:10.1110/ps.12801.
- ↑ Berkholz DS, Faber HR, Savvides SN, Karplus PA (octubre de 2008). «Catalytic cycle of human glutathione reductase near 1 A resolution». J. Mol. Biol. 382 (2): 371-84. PMC 2593804. PMID 18638483. doi:10.1016/j.jmb.2008.06.083.
- ↑ Rodríguez VM, Del Razo LM, Limón-Pacheco JH, Giordano M, Sánchez-Peña LC, Uribe-Querol E, Gutiérrez-Ospina G, Gonsebatt ME (marzo de 2005). «Glutathione reductase inhibition and methylated arsenic distribution in Cd1 mice brain and liver». Toxicol. Sci. 84 (1): 157-66. PMID 15601678. doi:10.1093/toxsci/kfi057.
- ↑ Elliott AJ, Scheiber SA, Thomas C, Pardini RS (octubre de 1992). «Inhibition of glutathione reductase by flavonoids. A structure-activity study». Biochem. Pharmacol. 44 (8): 1603-8. PMID 1329770. doi:10.1016/0006-2952(92)90478-2.
- ↑ Sarma GN, Savvides SN, Becker K, Schirmer M, Schirmer RH, Karplus PA (May 2003). «Glutathione reductase of the malarial parasite Plasmodium falciparum: crystal structure and inhibitor development». J. Mol. Biol. 328 (4): 893-907. PMID 12729762. doi:10.1016/s0022-2836(03)00347-4.
- ↑ Buchholz K, Schirmer RH, Eubel JK, Akoachere MB, Dandekar T, Becker K, Gromer S (January 2008). «Interactions of methylene blue with human disulfide reductases and their orthologues from Plasmodium falciparum». Antimicrob. Agents Chemother. 52 (1): 183-91. PMC 2223905. PMID 17967916. doi:10.1128/AAC.00773-07.
- ↑ Müller T, Johann L, Jannack B, Brückner M, Lanfranchi DA, Bauer H, Sanchez C, Yardley V, Deregnaucourt C, Schrével J, Lanzer M, Schirmer RH, Davioud-Charvet E (August 2011). «Glutathione reductase-catalyzed cascade of redox reactions to bioactivate potent antimalarial 1,4-naphthoquinones--a new strategy to combat malarial parasites». J. Am. Chem. Soc. 133 (30): 11557-71. PMID 21682307. doi:10.1021/ja201729z.
- ↑ Deponte M, Urig S, Arscott LD, Fritz-Wolf K, Réau R, Herold-Mende C, Koncarevic S, Meyer M, Davioud-Charvet E, Ballou DP, Williams CH, Becker K (May 2005). «Mechanistic studies on a novel, highly potent gold-phosphole inhibitor of human glutathione reductase». J. Biol. Chem. 280 (21): 20628-37. PMID 15792952. doi:10.1074/jbc.M412519200.
- ↑ Deponte M (May 2013). «Glutathione catalysis and the reaction mechanisms of glutathione-dependent enzymes». Biochim. Biophys. Acta 1830 (5): 3217-66. PMID 23036594. doi:10.1016/j.bbagen.2012.09.018.
- ↑ Champe PC, Harvey RA, Ferrier DR (2008). Biochemistry (fourth edición). Lippincott Williams and Wilkins. ISBN 978-0-7817-6960-0.
- ↑ a b Ramos PS, Oates JC, Kamen DL, Williams AH, Gaffney PM, Kelly JA, Kaufman KM, Kimberly RP, Niewold TB, Jacob CO, Tsao BP, Alarcón GS, Brown EE, Edberg JC, Petri MA, Ramsey-Goldman R, Reveille JD, Vilá LM, James JA, Guthridge JM, Merrill JT, Boackle SA, Freedman BI, Scofield RH, Stevens AM, Vyse TJ, Criswell LA, Moser KL, Alarcón-Riquelme ME, Langefeld CD, Harley JB, Gilkeson GS (junio de 2013). «Variable association of reactive intermediate genes with systemic lupus erythematosus in populations with different African ancestry». J. Rheumatol. 40 (6): 842-9. PMC 3735344. PMID 23637325. doi:10.3899/jrheum.120989.
- ↑ Gergely P, Grossman C, Niland B, Puskas F, Neupane H, Allam F, Banki K, Phillips PE, Perl A (enero de 2002). «Mitochondrial hyperpolarization and ATP depletion in patients with systemic lupus erythematosus». Arthritis Rheum. 46 (1): 175-90. PMC 4020417. PMID 11817589. doi:10.1002/1529-0131(200201)46:1<175::AID-ART10015>3.0.CO;2-H.
- ↑ a b c Yan J, Meng X, Wancket LM, Lintner K, Nelin LD, Chen B, Francis KP, Smith CV, Rogers LK, Liu Y (marzo de 2012). «Glutathione reductase facilitates host defense by sustaining phagocytic oxidative burst and promoting the development of neutrophil extracellular traps». J. Immunol. 188 (5): 2316-27. PMC 3480216. PMID 22279102. doi:10.4049/jimmunol.1102683.
- ↑ a b Kamerbeek NM, Zwieten R, Boer M, Morren G, Vuil H, Bannink N, Lincke C, Dolman KM, Becker K, Schirmer RH, Gromer S, Roos D (2007). «Molecular basis of glutathione reductase deficiency in human blood cells». Blood 109 (8): 3560-3566. PMID 17185460. doi:10.1182/blood-2006-08-042531.
- ↑ Roos D, Weening RS, Voetman AA, van Schaik ML, Bot AA, Meerhof LJ, Loos JA (mayo de 1979). «Protection of phagocytic leukocytes by endogenous glutathione: studies in a family with glutathione reductase deficiency». Blood 53 (5): 851-66. PMID 435643.
- ↑ Warsy AS, el-Hazmi MA (noviembre de 1999). «Glutathione reductase deficiency in Saudi Arabia». East. Mediterr. Health J. 5 (6): 1208-12. PMID 11924113.
- ↑ Cappellini MD, Fiorelli G (enero de 2008). «Glucose-6-phosphate dehydrogenase deficiency». Lancet 371 (9606): 64-74. PMID 18177777. doi:10.1016/S0140-6736(08)60073-2.
- ↑ Smith IK, Vierheller TL, Thorne CA (1988). «RAssay of glutathione reductase in crude tissue homogenates using 5,5'-dithiobis(2-nitrobenzoic acid)». Anal Biochem 175 (2): 408-13. PMID 3239770. doi:10.1016/0003-2697(88)90564-7.
- ↑ Marty L, Siala W, Schwarzländer M, Fricker MD, Wirtz M, Sweetlove LJ, Meyer Y, Meyer AJ, Reichheld JP, Hell R (2009). «The NADPH-dependent thioredoxin system constitutes a functional backup for cytosolic glutathione reductase in Arabidopsis». Proc Natl Acad Sci U S A 106 (22): 9109-14. PMC 2690020. PMID 19451637. doi:10.1073/pnas.0900206106.
- ↑ a b Gill SS, Anjum NA, Hasanuzzaman M, Gill R, Trivedi DK, Ahmad I, Pereira E, Tuteja N (septiembre de 2013). «Glutathione and glutathione reductase: a boon in disguise for plant abiotic stress defense operations». Plant Physiol. Biochem. 70: 204-12. PMID 23792825. doi:10.1016/j.plaphy.2013.05.032.
- ↑ Racker E (diciembre de 1955). «Glutathione reductase from bakers' yeast and beef liver». J. Biol. Chem. 217 (2): 855-65. PMID 13271446.
- ↑ Massey V, Williams CH (noviembre de 1965). «On the reaction mechanism of yeast glutathione reductase». J. Biol. Chem. 240 (11): 4470-80. PMID 4378936.
- ↑ Mapson LW, Isherwood FA (enero de 1963). «Glutathione reductase from germinated peas». Biochem. J. 86: 173-91. PMC 1201730. PMID 13932735.
- ↑ Schulz GE, Schirmer RH, Sachsenheimer W, Pai EF (mayo de 1978). «The structure of the flavoenzyme glutathione reductase». Nature 273 (5658): 120-4. PMID 25387. doi:10.1038/273120a0.
Lecturas adicionales
editar- Sinet PM, Bresson JL, Couturier J, Laurent C, Prieur M, Rethoré MO, Taillemite JL, Toudic D, Jérome H, Lejeune J (1977). «[Possible localization of the glutathione reductase (EC 1.6.4.2) on the 8p21 band]». Ann. Genet. (en francés) 20 (1): 13-7. PMID 302667.
- Krohne-Ehrich G, Schirmer RH, Untucht-Grau R (1978). «Glutathione reductase from human erythrocytes. Isolation of the enzyme and sequence analysis of the redox-active peptide». Eur. J. Biochem. 80 (1): 65-71. PMID 923580. doi:10.1111/j.1432-1033.1977.tb11856.x.
- Loos H, Roos D, Weening R, Houwerzijl J (1976). «Familial deficiency of glutathione reductase in human blood cells». Blood 48 (1): 53-62. PMID 947404.
- Tutic M, Lu XA, Schirmer RH, Werner D (1990). «Cloning and sequencing of mammalian glutathione reductase cDNA». Eur. J. Biochem. 188 (3): 523-8. PMID 2185014. doi:10.1111/j.1432-1033.1990.tb15431.x.
- Palmer EJ, MacManus JP, Mutus B (1990). «Inhibition of glutathione reductase by oncomodulin». Arch. Biochem. Biophys. 277 (1): 149-54. PMID 2306116. doi:10.1016/0003-9861(90)90563-E.
- Arnold HH, Heinze H (1990). «Treatment of human peripheral lymphocytes with concanavalin A activates expression of glutathione reductase». FEBS Lett. 267 (2): 189-92. PMID 2379581. doi:10.1016/0014-5793(90)80922-6.
- Karplus PA, Schulz GE (1987). «Refined structure of glutathione reductase at 1.54 A resolution». J. Mol. Biol. 195 (3): 701-29. PMID 3656429. doi:10.1016/0022-2836(87)90191-4.
- Pai EF, Schulz GE (1983). «The catalytic mechanism of glutathione reductase as derived from x-ray diffraction analyses of reaction intermediates». J. Biol. Chem. 258 (3): 1752-7. PMID 6822532.
- Krauth-Siegel RL, Blatterspiel R, Saleh M, Schiltz E, Schirmer RH, Untucht-Grau R (1982). «Glutathione reductase from human erythrocytes. The sequences of the NADPH domain and of the interface domain». Eur. J. Biochem. 121 (2): 259-67. PMID 7060551. doi:10.1111/j.1432-1033.1982.tb05780.x.
- Thieme R, Pai EF, Schirmer RH, Schulz GE (1982). «Three-dimensional structure of glutathione reductase at 2 A resolution». J. Mol. Biol. 152 (4): 763-82. PMID 7334521. doi:10.1016/0022-2836(81)90126-1.
- Huang J, Philbert MA (1995). «Distribution of glutathione and glutathione-related enzyme systems in mitochondria and cytosol of cultured cerebellar astrocytes and granule cells». Brain Res. 680 (1–2): 16-22. PMID 7663973. doi:10.1016/0006-8993(95)00209-9.
- Savvides SN, Karplus PA (1996). «Kinetics and crystallographic analysis of human glutathione reductase in complex with a xanthene inhibitor». J. Biol. Chem. 271 (14): 8101-7. PMID 8626496. doi:10.1074/jbc.271.14.8101.
- Nordhoff A, Tziatzios C, van den Broek JA, Schott MK, Kalbitzer HR, Becker K, Schubert D, Schirmer RH (1997). «Denaturation and reactivation of dimeric human glutathione reductase--an assay for folding inhibitors». Eur. J. Biochem. 245 (2): 273-82. PMID 9151953. doi:10.1111/j.1432-1033.1997.00273.x.
- Stoll VS, Simpson SJ, Krauth-Siegel RL, Walsh CT, Pai E (1997). «Glutathione reductase turned into trypanothione reductase: structural analysis of an engineered change in substrate specificity». Biochemistry 36 (21): 6437-47. PMID 9174360. doi:10.1021/bi963074p.
- Becker K, Savvides SN, Keese M, Schirmer RH, Karplus PA (1998). «Enzyme inactivation through sulfhydryl oxidation by physiologic NO-carriers». Nat. Struct. Biol. 5 (4): 267-71. PMID 9546215. doi:10.1038/nsb0498-267.
- Kelner MJ, Montoya MA (2000). «Structural organization of the human glutathione reductase gene: determination of correct cDNA sequence and identification of a mitochondrial leader sequence». Biochem. Biophys. Res. Commun. 269 (2): 366-8. PMID 10708558. doi:10.1006/bbrc.2000.2267.
- Qanungo S, Mukherjea M (2001). «Ontogenic profile of some antioxidants and lipid peroxidation in human placental and fetal tissues». Mol. Cell. Biochem. 215 (1–2): 11-9. PMID 11204445. doi:10.1023/A:1026511420505.
- Berry Y, Truscott RJ (2001). «The presence of a human UV filter within the lens represents an oxidative stress». Exp. Eye Res. 72 (4): 411-21. PMID 11273669. doi:10.1006/exer.2000.0970.
- Rhie G, Shin MH, Seo JY, Choi WW, Cho KH, Kim KH, Park KC, Eun HC, Chung JH (2001). «Aging- and photoaging-dependent changes of enzymic and nonenzymic antioxidants in the epidermis and dermis of human skin in vivo». J. Invest. Dermatol. 117 (5): 1212-7. PMID 11710935. doi:10.1046/j.0022-202x.2001.01469.x.
- Zatorska A, Józwiak Z (2003). «Involvement of glutathione and glutathione-related enzymes in the protection of normal and trisomic human fibroblasts against daunorubicin». Cell Biol. Int. 26 (5): 383-91. PMID 12095224. doi:10.1006/cbir.2002.0861.