Acetilo
En química orgánica, acetilo (etanoílo), generalmente abreviado a acetil (etanoíl), es un grupo funcional, específicamente un radical, el acilo del ácido acético, con fórmula química -COCH3. Algunas veces se abrevia como Ac (no confundir con el elemento químico actinio). El radical acetilo contiene un grupo metilo unido por un enlace simple a un grupo carbonilo. El átomo de carbono del grupo carbonilo tiene un electrón desapareado disponible, con el que forma un enlace químico al resto R de la molécula.
| Acetilo | ||
|---|---|---|
 Estructura tridimensional | ||
| Nombre IUPAC | ||
| Acetilo (preferido a etanoilo)[1][2][3] | ||
| General | ||
| Fórmula estructural |
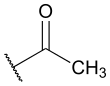 | |
| Fórmula molecular | C2H3O | |
| Identificadores | ||
| Número CAS | 3170-69-2[4] | |
| ChEBI | 46887 | |
| ChemSpider | 121499 | |
| PubChem | 137849 | |
| UNII | J05788U23A | |
|
C[C]=O
| ||
| Propiedades físicas | ||
| Masa molar | 43,045 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El radical acetilo es un componente de muchos compuestos orgánicos, incluyendo el neurotransmisor acetilcolina, y la acetil-CoA, el analgésico acetaminofén y la aspirina.
Acetilación
editarLa introducción de un grupo acetilo en una molécula se denomina acetilación (o, menos comúnmente, etanoilación). En los seres vivos, los grupos acetilo suelen ser transferidos unidos a la Coenzima A (CoA), en la forma de acetil-CoA. El acetil-CoA es un intermediario importante tanto en la síntesis biológica como en la degradación de muchas moléculas orgánicas.
Los grupos acetilo también son agregados frecuentemente a las histonas y otras proteínas, modificando sus propiedades. Por ejemplo, a nivel de ADN, la acetilación de la histona por acetiltransferasas (HATs) origina una expansión de la arquitectura de cromatina, permitiendo que suceda la transcripción genética. Del mismo modo, la eliminación del grupo acetilo por histona deacetilasas (HDACs) condensa la estructura de ADN, con lo que se impide la transcripción.[5]
La acetilación química puede lograrse usando una variedad de métodos, más comúnmente por el uso de anhídrido acético o cloruro de acetilo en la presencia de una base amina terciaria o aromática.
Farmacología
editarCuando los grupos acetilo se unen a ciertas moléculas orgánicas, les imparten una habilidad aumentada para cruzar la barrera hematoencefálica. Esto hace que la droga alcance al cerebro más rápidamente, haciendo que los efectos de la droga sean más intensos, e incrementan su efectividad a una dosis dada. Los grupos acetilo se usan para hacer que el antiinflamatorio natural ácido salicílico se convierta en el ácido acetilsalicílico, la aspirina, que es más efectiva. Del mismo modo, convierte el analgésico natural morfina en la heroína (diacetilmorfina).[6]
Referencias
editar- ↑ «List of Radical Names Beginning from "A"». Nomenclature of Organic Chemistry, Sections A, B, C, D, E, F, and H, Pergamon Press, Oxford, 1979. Copyright 1979 IUPAC.
- ↑ «R-5.7.1 Carboxylic acids, where acetyl appears as an example». IUPAC, Commission on Nomenclature of Organic Chemistry. A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993), 1993, Blackwell Scientific publications, Copyright 1993 IUPAC.
- ↑ Favre, Henri A.; Powell, Warren H. (17 de diciembre de 2013). Nomenclature of Organic Chemistry (en inglés). ISBN 978-0-85404-182-4. Consultado el 15 de mayo de 2020.
- ↑ Número CAS
- ↑ North B, Verdin E (2004). «Sirtuins: Sir2-related NAD-dependent protein deacetylases». Genome Biol 5 (5): 224. PMID 15128440. doi:10.1186/gb-2004-5-5-224.
- ↑ Koide K, Epperly M, Franicola D, Dixon T, Zhang X, Komanduri P, Greenberger B, Greenberger J (2008). «Acetylated Resveratrol: A New Small Molecule Radioprotector». International Journal of Radiation OncologyBiologyPhysics 72 (1): S697-S697. doi:10.1016/j.ijrobp.2008.06.598.