Potencial normal de electrodo
En electroquímica, el potencial normal de electrodo o potencial normal de reducción de electrodo de un elemento, que se abrevia Eo (con un superíndice que se lee como "normal" o "estándar"), es la diferencia de potencial que le corresponde a una celda o semipila construida con un electrodo de ese elemento y un electrodo estándar de hidrógeno, cuando la concentración efectiva o actividad de los iones que intervienen en el proceso es 1 mol/L (1 M), la presión de las sustancias gaseosas es 1 atmósfera, y la temperatura es 298 K (25 °C). El potencial normal de electrodo se representa habitualmente como Eº y su unidad en el Sistema Internacional es el voltio (V).[1] Es un valor constante de cada electrodo e indica la tendencia a oxidarse o reducirse que posee la sustancia implicada en la semirreacción.[2]
Potencial de una pila o célula electroquímica
editarEl fundamento de una célula electroquímica, como la pila galvánica, es siempre una reacción redox que se puede desglosar en dos semirreacciones:
- la oxidación (pérdida de electrones) tiene lugar en el ánodo, que es el electrodo negativo, y
- la reducción (ganancia de electrones) transcurre en el cátodo o polo positivo.
La electricidad se genera debido a la diferencia de potencial eléctrico entre estos dos electrodos. Esta diferencia de potencial se crea como resultado de la diferencia entre los potenciales individuales de los dos electrodos en relación con el electrólito o disolución en la que están sumergidos. El potencial de dicha célula será la diferencia entre el potencial del electrodo positivo (cátodo, donde se realiza la reducción) y el potencial del electrodo negativo (ánodo, donde se realiza la oxidación).
Aunque el potencial global de una célula se puede medir, no hay ninguna manera sencilla de medir con precisión el potencial de un solo electrodo aislado. Dicho potencial eléctrico también varía con la temperatura, la concentración y la presión. Dado que el potencial de oxidación de una semirreacción es de igual valor pero con signo contrario que el potencial de reducción de esa misma semirreacción redox, esto nos sirve para calcular cualquiera de los potenciales. Por convenio, el potencial normal o estándar de electrodo se escribe comúnmente como el potencial de reducción estándar para dicho electrodo.
Cálculo de potenciales normales de electrodo o estándar
editarEl valor del potencial de electrodo no se puede obtener de manera empírica. Una pila galvánica resulta de la unión de un par de electrodos. Así, solo se conoce el valor experimental correspondiente a un par de electrodos y no es posible determinar el valor de cada electrodo individual de la pareja a partir del potencial obtenido empíricamente para la pila galvánica. Es necesario establecer un electrodo de referencia, el electrodo normal de hidrógeno, cuyo potencial se define o se acuerda por convenio. En este caso se establece en 0,000 V el potencial de referencia del electrodo normal de hidrógeno y cualquier electrodo, cuyo potencial de electrodo no sea conocido aún, se puede combinar con el electrodo normal de hidrógeno - para formar una pila galvánica - y el potencial de dicha pila galvánica es el potencial del electrodo desconocido. Utilizando este proceso, cualquier electrodo con un potencial desconocido puede ser emparejado con el electrodo normal de hidrógeno, o bien con otro electrodo cuyo potencial ya sea conocido y llegar así a conocer el valor del electrodo desconocido.
Dado que los potenciales de electrodo se definen convencionalmente como potenciales de reducción, el signo del potencial del electrodo donde se produce la oxidación debe invertirse en el cálculo del potencial de la pila en general y por eso va precedido del signo menos. Téngase en cuenta que los potenciales de electrodo son independientes del número de electrones transferidos; es decir, están fijados para un mol de electrones transferidos, y así los dos potenciales de electrodo puede ser simplemente combinados para dar el potencial general de la celda, restando el mayor menos el menor, incluso si diferente número de electrones participan en las dos reacciones de los electrodos.
Medida experimental de los potenciales normales de reducción
editarPara las mediciones prácticas, el electrodo en cuestión se conecta al terminal positivo del electrómetro, mientras que el electrodo normal de hidrógeno se conecta al terminal negativo.[3]
Los valores de los potenciales normales de electrodo así calculados suelen estar tabulados para una temperatura de 25 °C. Estos potenciales sirven para predecir el funcionamiento de una célula electroquímica.
Tabla de potenciales normales de reducción
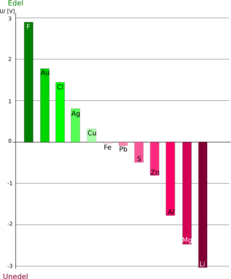
editarDado que los valores de los potenciales de electrodo indican la capacidad para reducirse que posee dicho electrodo, cuanto mayor es el potencial de reducción de un electrodo, más fácilmente se va a reducir, en otras palabras, que es un agente oxidante mejor. Por ejemplo, el electrodo flúor/fluoruro, F2/F-, tiene un potencial de reducción de 2,87 V, y el electrodo de litio, Li+/Li, tiene un valor de -3,05 V. El flúor se reduce fácilmente y es por tanto un buen agente oxidante. . En contraste, el litio sólido, Li(s), prefiere someterse a la oxidación (por tanto, es un buen agente reductor). Así, el ion zinc, Zn2+, cuyo potencial de reducción estándar es de -0,76 V puede ser oxidado por cualquier otro electrodo cuyo potencial de reducción estándar sea mayor que -0,76 V (por ejemplo, H+ (0 V), Cu2+ (0,16 V), o F2 ( 2,87 V)); y puede ser reducido por cualquier electrodo con un potencial de reducción estándar sea inferior a -0,76 V (por ejemplo, H2 (-2,23 V), Na+ (-2.71 V), o Li+ (-3,05 V)).
En una pila galvánica, cuando una reacción redox espontánea produce una corriente eléctrica, la energía libre de Gibbs debe ser negativa, de conformidad con la siguiente ecuación:
donde es el número de moles de electrones por mol de productos y es la constante de Faraday, ~ 96485 C/mol. Como tal, se aplicarán las siguientes reglas:
- Si , entonces el proceso es espontáneo (célula galvánica o pila)
- Si , entonces el proceso NO es espontáneo (celda electrolítica)
Así, con el fin de tener una reacción espontánea ( ), se debe cumplir que , donde:
donde es el potencial estándar del ánodo (el signo del valor del potencial de reducción estándar para ese electrodo se ha invertido y por ello lleva un signo menos delante) y es el potencial estándar del cátodo, tal como figura en el cuadro o tabla de potenciales de electrodo estándar.
Condiciones no estándar
editarLos potenciales de electrodo estándar se dan en condiciones estándar (concentraciones de 1 mol/L, presión de 1 atm y temperatura de 25 °C). Sin embargo, las células reales pueden operar bajo condiciones no estándar. Dado el potencial estándar de una semipila, su potencial para concentraciones eficaces (actividades no estándar) puede calcularse utilizando la ecuación de Nernst:[4]
donde Q es el cociente de reacción.
Los valores de Eo dependen de la temperatura (con excepción del electrodo normal de hidrógeno, porque su potencial ha sido arbitrariamente fijado a 0 para todas las temperaturas) y normalmente se hace referencia a la SHE a la misma temperatura. Para fases condensadas, también se espera que dependerá un poco de la presión (véase el artículo sobre la constante de equilibrio). Por ejemplo, el potencial de electrodo estándar del par redox Ni / NiO se ha estudiado bien porque tal sólido tiene aplicaciones como pseudo-electrodo de referencia a alta temperatura (cuando se encierra dentro de una membrana cerámica de zirconio estabilizada con ytrio). La reacción de la semipila para este par redox es la siguiente:
El potencial estándar del par Ni / NiO se ha correlacionado para temperaturas entre 0 y 400 °C y responde aproximadamente a la expresión:[5]
donde E° está en voltios, y t está en grados Celsius (°C).
En bioquímica, los potenciales se definen habitualmente para pH=7, con el potencial normal en estas condiciones representado por E°′, también conocido como el potencial del punto medio o Em,7 porque es el potencial al que las concentraciones de las formas oxidadas y las reducidas de la pareja redox son iguales.
El potencial redox real de un par redox para un pH específico x (Eh, pH = x) está relacionado con el potencial del punto medio por la expresión:
Véase también
editarReferencias
editar- ↑ Elementos químicos. Archivado el 6 de marzo de 2009 en Wayback Machine. Jesús Peñas Cano. Educamadrid.
- ↑ Fundamentos de electroquímica. En: Introducción a la química analítica. Douglas A. Skoog, Donald M. West. Editorial Reverté, 2002. ISB: 8429175113. Pág. 369
- ↑ IUPAC definition of the electrode potential
- ↑ http://www.textoscientificos.com/quimica/inorganica/redox/ecuacion-nernst Ecuación de Nernst. Textos científicos.
- ↑ R.W. Bosch, D. Feron, and J.P. Celis, "Electrochemistry in Light Water Reactors", CRC Press, 2007.
Lecturas adicionales
editarEn inglés
editar- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
En español
editar- Cap. X: Fundamentos de electroquímica. En: Química cuantitativa. Glenn Brown. Editorial Reverté, 1977. ISBN 8429170804 Pág. 272
- Cap. 13: Pilas electroquímicas. En: Química física, Volumen 1. Arthur W. Adamson. Editorial Reverté, 1979. ISBN 429170197 Pág. 665
Enlaces externos
editarEn inglés
editarEn español
editar- Electrodos de referencia. La ciencia para todos. Instituto Latinoamericano de la Comunicación Educativa. México.
- Pilas electroquímicas. Técnicas fisicoquímicas en medio ambiente. UNED.
- Principios termodinámicos de las pilas electroquímicas. Biblioteca digital de la universidad de Chile.
- Electroquímica y corrosión. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). Universidad de Holguín "Oscar Lucero Moya".