Valoración ácido-base
Una valoración ácido-base (también llamada volumetría ácido-base, titulación ácido-base o valoración y/o equivalente de neutralización) es una técnica o método de análisis cuantitativo de uso frecuente utilizado para determinar la concentración de un analito en disolución con propiedades ácidas, neutralizada por medio de una base de concentración conocida, o bien, a la inversa, de una base, en cuyo caso se utiliza como valorante una disolución patrón de ácido.[1] Son por tanto valoraciones de neutralización ácido-base. El nombre volumetría hace referencia a la medida del volumen de las disoluciones empleadas, que nos permite calcular la concentración buscada.

Aparte del cálculo de concentraciones, una valoración ácido-base permite conocer el grado de pureza de ciertas sustancias.
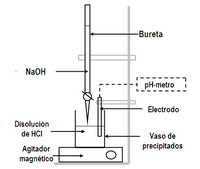
Método y material empleado
editarEl material básico empleado para una valoración ácido-base es:
- Bureta
- Vaso precipitados
- Mesa o soporte de fondo blanco - se emplea para apreciar el cambio de color de la disolución.
- Pipeta
- Indicador de pH o Indicador ácido-base (se emplean muchos diferentes, según la reacción)
- Matraz Erlenmeyer (matraz cónico)
- Disolución estándar (una disolución de concentración conocida, como la de Na2CO3 en agua)
- Disolución o muestra cuya concentración queremos conocer.
En una valoración ácido-base a veces es frecuente el uso de un indicador ácido-base que sufra un cambio de color en las inmediaciones del punto final. También se puede emplear un pH-metro con esta misma finalidad[2], en cuyo caso se registra la variación del pH a medida transcurre transcurre la transferencia de hidrogeniones, H+, entre el ácido y la base. Para ello se emplean electrodos específicos conectados a un potenciómetro. Cerca del punto de equivalencia o punto final de la valoración se observa un cambio muy brusco de dicho potencial. En otros casos, si el reactivo valorante o la sustancia valorada experimentan un cambio de color puede utilizarse esta característica para establecer el punto final de la valoración.
Clases de valoración ácido-base
editarSe pueden clasificar en dos grandes grupos:
- Alcalimetrías: Determinación de la concentración de una base empleando un ácido fuerte de concentración conocida como sustancia valorante. Se emplea casi siempre ácido clorhídrico, HCl; a veces ácido sulfúrico, H2SO4 (Las disoluciones de ácido perclórico y de ácido sulfúrico también son estables y son útiles para las titulaciones donde el ion cloruro interfiere formando precipitados); y casi nunca los ácidos nítrico (HNO3) y perclórico, (HClO4).
- Acidimetrías. Determinación de la concentración de un ácido empleando una base fuerte de concentración conocida como sustancia valorante, como el NaOH.
Curvas de valoración
editarSi se representa el pH medido por un electrodo en función del volumen añadido de sustancia valorante se obtienen curvas de valoración o curvas de titulación, similares a la de la figura. Se observa el rápido cambio del pH para un volumen determinado. El punto de inflexión de esta curva se llama punto de equivalencia y su volumen nos indica el volumen de sustancia valorante consumido para reaccionar completamente con el analito.[3]
En ausencia de sistema medidor del pH, se pueden usar indicadores ácido-base, sustancias que mediante un cambio de color indican que se ha llegado al punto final de la titulación, el cual debe ser lo más cercano posible al punto de equivalencia. La elección adecuada del indicador visual nos asegura que así sea.
Punto de equivalencia: valor del pH
editarAntes de iniciar la valoración se debe elegir un indicador de pH adecuado según el punto de equivalencia previsto de la reacción. El punto de equivalencia se corresponde con el valor teórico de la valoración, pero en la práctica no es posible conocer con exactitud. En dicho punto habrán reaccionado cantidades estequiométricas de ambos reactivos, y el pH de dicho punto depende de la fuerza relativa del ácido y la base empleados. Para conocer dicho valor se pueden emplear las siguientes reglas:
- Un ácido fuerte reacciona con una base fuerte para formar una disolución neutra (pH = 7).
- Un ácido fuerte reacciona con una base débil para formar una disolución ácida (pH <7).
- Un ácido débil reacciona con una base fuerte para formar una disolución básica (pH> 7).
La disolución en el punto de equivalencia será básica si la base es más fuerte que el ácido y será ácida si el ácido es más fuerte que la base. Si ambos son de igual fuerza, entonces el pH de equivalencia será neutro. Sin embargo, los ácidos débiles no se valoran normalmente frente a bases débiles, porque el cambio de color mostrado por el indicador suele ser rápido, y por lo tanto muy difícil de ver con claridad por el observador.
Encontrar el punto de equivalencia sería lo ideal en una valoración, pero, en realidad, lo que se determina es el punto final, el punto en que se detiene la valoración, el cual se caracteriza por un cambio brusco de alguna propiedad física o química de la solución, como por ejemplo, el cambio de color de una sustancia química añadida, denominada indicador o el cambio repentino del pH de la disolución. Este cambio producido en la disolución permite establecer experimentalmente el punto final de la valoración. [4]
El punto final debe coincidir lo más exactamente posible con el punto de equivalencia. La diferencia entre ambos puntos constituye el error de valoración, que es propio del método (indicador empleado, uso de reactivos impuros, etc), y no debemos confundirlo con los errores accidentales debidos a manipulaciones o medidas de volumen defectuosas.
Determinación del punto final
editarSon muy numerosos los métodos para detectar el punto final de la valoración. Aparte de los métodos más frecuentes (uso de indicadores visuales y medida directa del pH con potenciómetro) se pueden usar otros métodos:[5]
- Valoración potenciométrica: Es una medida basada en la diferencia de potencial entre un electrodo adecuado frente a un electrodo de referencia (electrodo de calomelanos de potencial fijo) en función del volumen de sustancia valorante. No confundir con la medida directa de potencial que efectúa el pH-metro. Proporcionan resultados más fiables que las valoraciones con indicadores químicos o ácido-base. Se emplean dos electrodos, en lugar de uno sólo. En el punto final hay una rápida modificación del potencial. Representando la derivada en función del volumen, se observa un pico que corresponde al punto final. También se observa en la segunda derivada. Estas medidas de potencial también permiten calcular la constante de disociación del ácido o la base que se está valorando.[6]
- Valoración fotométrica. Se emplean espectrómetros o fotómetros de filtro. Se trata de comprobar cómo varía la absorbancia de la muestra en función del volumen de disolución valorante añadido. Aunque los ácidos y bases no absorben, basta añadir un indicador ácido-base para controlar el avance de la neutralización.
- Valoración conductimétrica. Se mide la conductividad de la disolución en función del volumen añadido. Sirve para valorar ácidos o bases muy débiles, o disoluciones muy diluidas. No puede aplicarse a muchos procesos.[7]
- Valoración amperométrica. Se aplican más a valoraciones redox que a valoraciones ácido-base.
- Valoración termométrica o calorimetría. Se trata de detectar los aumentos de temperatura durante la valoración.
- Valoración culombimétrica: Consta de un electrodo donde se obtiene un reactivo y otro contraelectrodo con la muestra. Se le hace pasar una corriente constante (amperioestato) durante un tiempo. Dicha corriente, por ejemplo, libera una cantidad de iones OH- (en un electrodo de Hg) proporcional a la carga que lo atraviesa. Según las leyes de Faraday, conociendo la intensidad de corriente que circula por la célula y el tiempo, se puede calcular los moles de OH- formados y, a partir de ahí, los moles de ácido en la muestra. Este método no presenta las interferencias del ion carbonato en la valoración de ácidos y no requiere preparar o estandarizar disoluciones.[6]
Medida del punto de equivalencia con el potenciómetro
editarUn pH-metro es un instrumento que mide el pH de una disolución, y sirve para detectar el punto final de una valoración ácido-base. Consta de un electrodo de plata-cloruro de plata, de potencial constante, en una disolución 0,1 M de HCl dentro de una membrana de vidrio que mide la actividad de los iones H+ capaces de atravesarla, y de una unidad lectora que hace una medida directa del potencial eléctrico del electrodo y señala en una pantalla el valor del pH.[8]
Ecuación de Henderson-Hasselbach que indica el pH en función de las concentraciones de las formas ácida (HA) y básica (A-) de una sustancia.
Valoración de ácidos débiles
editarCuando se titula o valora un ácido débil con una base fuerte, el pH antes del punto de equivalencia se puede calcular mediante la siguiente fórmula, llamada Ecuación de Henderson-Hasselbach:[9]
donde:
- pKa es el potencial de la constante de acidez del ácido débil.
- [OH-]añadido es la concentración de base fuerte añadida a la disolución final (no a la disolución estándar original)
- [HA]total es la suma de las concentraciones de ácido, HA, y de su base conjugada, A-, en la disolución final.
Así, si añadimos una base fuerte de forma que su concentración sea la mitad de la cantidad de ácido débil presente en la solución, es decir ([OH-]añadido = 0,5 · [HA]total, el pH es igual al pKa.
La fórmula más general[10] que describe la valoración de un ácido débil con una base fuerte es la siguiente
- = fracción de la finalización de la valoración (φ <1 es antes del punto de equivalencia, φ = 1 en el punto de equivalencia, y φ> 1 después del punto de equivalencia)
- = las concentraciones del ácido y la base, respectivamente,
- = los volúmenes del ácido y la base, respectivamente,
- = La fracción del ácido débil que se ioniza (grado de disociación)
Cálculos
editarSe debe cumplir en cualquier valoración ácido-base la siguiente expresión:
o bien
Esto se puede escribir también como:
donde:
; ;
;
En el balance final
Ejemplo: Queremos valorar 25 ml de disolución de NaOH (concentración desconocida), empleando disolución de H2SO4 0,35 mol/L, según la ecuación:
2 NaOH + H2SO4 → Na2SO4 + 2 H2O
El volumen de esta última disolución en el punto de equivalencia (ver gráfico) ha sido de 20 mL. Luego:
Vaci · Maci · n.º H+ cedidos = Vbas · Mbas · n.º H+ ganados ( o de OH- cedidos)
20 mL · 0,35 mol/L · 2 = 25 mL · Mbas · 1 ; Mbas=0,56 mol/L
Indicadores ácido-base
editar| Indicador[11] | Color 1 | Zona de viraje | Color 2 |
|---|---|---|---|
| Rojo de cresol (1º) | Rojo | 0,2-1,8 | Amarillo |
| Azul de timol (1º) | Rojo | 1,2-2,8 | Amarillo |
| Rojo congo | Azul-violeta | 3,0-5,2 | Rojo |
| Naranja de metilo | Rojo | 3,1-4,4 | Amarillo-anaranjado |
| Azul de bromocresol | Celeste | 3,8-5,4 | Verde |
| Verde de bromocresol | Amarillo | 3,8-5,4 | Azul-verdoso |
| Rojo de metilo | Rojo | 4,2-6,2 | Amarillo |
| Tornasol | Rojo | 5,0-8,0 | Azul |
| Púrpura de bromocresol | Amarillo | 5,2-6,8 | Púrpura |
| Azul de bromotimol | Amarillo | 6,0-7,6 | Azul |
| Rojo neutro | Rojo | 6,8-8,4 | Amarillo |
| Rojo de cresol (2º) | Amarillo | 7,1-8,8 | Púrpura |
| Azul de timol (2º) | Amarillo | 8,0-9,6 | Azul |
| Fenolftaleína | Incoloro | 8,2-10,0 | Magenta |
| Timolftaleína | Incoloro | 9,3-10,5 | Azul |
| Carmín de índigo | Azul | 11,6-14,0 | Amarillo |
Un indicador es un colorante que sufre un cambio de color cuando se modifica el pH. Se deben elegir de modo que coincida dicho cambio o viraje al mismo tiempo que se llega al punto de equivalencia de la valoración ácido-base por lo que sirven para indicar dicho punto. Suelen ser ácidos o bases orgánicos débiles y la zona de viraje de cada indicador se sitúa aproximadamente entre una unidad de pH por debajo y una unidad por encima del valor de su pKa.
Zona de viraje= (pKa-1, pKa+1)
Una clasificación de los indicadores los subdivide en:
- Autoindicadores. La propia sustancia valorante o el analito actúan de indicador, pues cambian de color a lo largo de la reacción. Un ejemplo típico es el permanganato de potasio.
- Indicadores coloreados. Son los más usados; suelen añadirse al sistema a valorar, introduciendo directamente unas gotas en la disolución del analito, pero otras veces se extraen pequeñas fracciones de ésta y se ensaya externamente con el indicador. Sus coloraciones deben ser intensas para percibir claramente el cambio de color.
- Indicadores fluorescentes. Funcionan de modo parecido a los indicadores coloreados, aunque son menos numerosos. El final de la valoración se pone de manifiesto por la aparición, desaparición o cambio de la fluorescencia de la disolución problema sometido a la luz ultravioleta.
- Indicadores de adsorción. Son sustancias que cambian de color al ser adsorbidas o desorbidas por los coloides que se forman en el seno de la disolución problema como resultado de la reacción entre el analito y la sustancia valorante.
Frente a los indicadores fisicoquímicos, que registran cambios en algunas propiedades (pH...), los indicadores químicos son sustancias que exhiben estos cambios de color.
- Los indicadores ácidos presentan equilibrios del tipo:[12]
Al grupo de los indicadores ácidos pertenecen el azul de timol (sufre un primer viraje a un pH aproximado de 2, y un segundo cambio, próximo a 9), verde de bromocresol, púrpura de bromocresol, azul de bromotimol, rojo de fenol, púrpura de cresol, fenolftaleína y timolftaleína.
- Los indicadores básicos presentan equilibrios del tipo:
Al grupo de los indicadores básicos pertenecen el amarillo de metilo, naranja de metilo, rojo de metilo y amarillo de alizarina GG.
Uno de los indicadores más empleados es el papel indicador, un papel absorbente impregnado en una mezcla de indicadores y que muestra un color diferente para cada unidad de pH.[13]
Elección del indicador
editarEl punto en el que el indicador cambia de color se llama punto final. Se debe elegir un indicador adecuado, preferiblemente uno que experimente un cambio de color (punto final) cerca del punto de equivalencia de la reacción.
En primer lugar, la bureta debe lavarse con la disolución estándar, la pipeta con la solución desconocida, y el erlenmeyer con agua destilada.
En segundo lugar, un volumen conocido de la solución de concentración desconocida se debe tomar con la pipeta y se coloca en el matraz Erlenmeyer o en un vaso de precipitados, junto con unas gotas del indicador elegido (o el electrodo del pH-metro). La bureta debe llenarse siempre hasta la parte superior de su escala con la solución conocida, para facilitar la lectura.
Se vierte sobre el matraz la disolución conocida, abriendo la llave de la bureta. En esta etapa queremos hacer una estimación aproximada de la cantidad de esta solución que necesitaremos para neutralizar la solución desconocida. Se debe dejar salir la disolución de la bureta hasta que el indicador cambia de color y, entonces, anotamos el valor que marca la bureta para saber el volumen gastado. Esta primera valoración es aproximada y debe ser desestimada para los cálculos.
| Ácido | Base | Indicador | Zona de viraje |
|---|---|---|---|
| Fuerte | Fuerte | Azul de bromotimol | |
| Fuerte | Débil | Naranja de metilo | |
| Débil | Fuerte | Fenolftaleína | |
| Débil | Débil | No se valora | |
| Débil (pH> 5,5) | Muy Fuerte (pH> 13,5) | Amarillo de alizarina | |
| Muy fuerte (pH <0,5) | Débil (pH <8,5) | Azul de timol |
Se deben realizar tres valoraciones más, ahora más lentamente y con mayor precisión, sobre todo cuando se esté cerca del punto final previsto. Las tres lecturas de la bureta en el punto final deben ser registradas, y se promedian para dar el resultado final. El punto final se alcanza justo cuando el indicador cambia de color de forma permanente.
Obsérvese en la tabla de la derecha el indicador que podemos elegir en función de la fuerza relativa del ácido y la base. Por ejemplo, para valorar ácido acético (un ácido débil) con hidróxido de sodio (una base fuerte), debemos usar fenolftaleína como indicador o introducir un electrodo conectado a un pH-metro, que registre un cambio brusco del pH, que indica el punto final.
Estandarización de disoluciones para valoración
editarLas disoluciones de las sustancias valorantes deben ser estandarizadas antes de su empleo como sustancias valorantes, es decir, su concentración debe ser medida experimentalmente frente a una sustancia que actúa como patrón primario, y no sólo calculada a partir de la masa empleada para la disolución.[14]
Esto es necesario porque dichas sustancias no son completamente puras, pueden sufrir alteraciones en el proceso de disolución, o posteriormente durante con el tiempo transcurrido.
En las valoraciones ácido-base se emplean ácidos fuertes (como HCl) y bases fuertes (como NaOH) como sustancias valorantes, pero no son patrones primarios y sus disoluciones deben ser estandarizadas.
- Estandarización de una disolución de NaOH.
El hidróxido sódico sólido comercial no es de gran pureza y puede tener restos de carbonato de sodio. Se disuelve un peso conocido en agua destilada y se le añade agua hasta alcanzar un volumen conocido en un matraz aforado. Por ejemplo, una masa de 4 gramos de NaOH disueltos en agua hasta un volumen total de 1 litro, forman una disolución de concentración aproximada 0,1 M (molar). Al no ser un patrón primario, es necesario estandarizarla para conocer exactamente su concentración. Puede realizarse valorándola con ftalato ácido de potasio, que sí es un patrón primario, usando fenolftaleína como indicador.
- Estandarización de una disolución de HCl.
El ácido clorhídrico comercial no es patrón primario. Una disolución preparada mezclando 8,3 mL de HCL comercial (37% de pureza y densidad 1,18 g/mL), con suficiente cantidad de agua hasta completar un matraz aforado con un volumen total de 1 litro, tendrá una concentración aproximada de 0,1 M (molar). Al no ser un patrón primario, esta disolución se debe estandarizar. Para ello, se valora con carbonato de sodio, Na2CO3, que sí es un patrón primario, empleando fenolftaleína y anaranjado de metilo como indicadores. El viraje de la fenolftaleína se produce cuando el CO32- se ha transformado en HCO3-.
Otros patrones primarios son ácido oxálico, H2C2O4, tetraborato de sodio, Na2B4O7, y óxido de mercurio (II), HgO.
En ese momento se añaden unas gotas de anaranjado de metilo, que vira cuando todo el HCO3- se convierte en H2CO3, que se descompone en CO2 y H2O.
Ejemplo de acidimetría: Determinación de la acidez de un aceite de oliva
editar1.- Preparación y estandarización de la disolución valorante:
- Se prepara una disolución de NaOH de concentración aproximada 0,5 M.
- Se echa en una bureta para ser estandarizada.
- Se pesa una masa de 0,5000 g de hidrógenoftalato de potasio en una balanza de precisión.
- Se coloca en un vaso con agitador magnético y se le añade agua destilada hasta un volumen aproximado de 50 mL.
- Se añaden dos gotas de fenolftaleina.
- Se añade el hidróxido de sodio a la disolución del ácido, hasta que el indicador pase de incoloro (en medio ácido) a rosa (en medio básico).
- Hacer los cálculos para ver la concentración real de NaOH.
2.- Se valora con ella el aceite de oliva.[15]
- Se pesa en un matraz Erlenmeyer 30 g del aceite de oliva cuya acidez queremos conocer.
- Disolverlo en 100 mL de una mezcla alcohol etílico-éter etílico 1:1.
- Se añaden dos gotas de fenolftaleina y se coloca en el agitador magnético.
- Con ayuda de la bureta se vierte gota a gota el hidróxido de sodio a la disolución del aceite hasta que el indicador pase de incoloro (en medio ácido) a rosa (en medio básico). La disolución se verá naranja debido al color amarillo del aceite.
- Hacer los cálculos para ver la concentración de ácido oleico, los moles totales, la masa y el porcentaje de acidez, habitualmente entre 0,4 y 3%
Aplicaciones de las valoraciones ácido-base
editarSon muchas las aplicaciones de estas valoraciones:[5]
- Determinación de ácidos y bases: Se utiliza el indicador de fenoftaleína. Este, genera un cambio de incoloro a rosa, con un pH aproximadamente de 8,4. Este valor, se encuentra muy cerca del punto de equivalencia en las valoraciones más comunes.
- Determinación de mezclas de bicarbonatos y carbonatos: Para la determinación de bicarbonatos o la alcalinidad total) ha de usarse un indicador como la mezcla de azul de timol y rojo de cresol (también conocido como método de Magni[cita requerida]). Se recomienda utilizar este tipo de indicadores, ya que se caracterizan por presentar dos puntos de viraje que normalmente se activan en las mezclas de distintos compuestos en consecuencia de la reacción.
- Determinación de hidróxidos con o sin presencia de carbonatos.
- Determinación de nitrógeno en compuestos orgánicos mediante el método de Kjeldahl, que se basa en una volumetría ácido-base (el volumen de disolución básica consumido hasta llegar al punto de equivalencia permite conocer la cantidad de NH3, y de esta forma, la cantidad de nitrógeno en la muestra).
- Control de desechos industriales: las sustancias ácidas o básicas se neutralizan antes de ser desechadas, para evitar que puedan contaminar el agua de ríos o mares.
- Control de la acidez de alimentos tales como vinagres, jugos, productos lácteos y aceites.
- Análisis de aguas, fertilizantes amoniacales y detergentes industriales a base de ácido fosfórico.
- Control de acidez de productos de limpieza, tales como jabones o lavandina.
- Elaboración de productos de higiene, tales como el champú, cuyo pH debe encontrarse alrededor de 5, dado que este es el valor aproximado del pH de la piel.
- Usos extendidos en la petroquímica, entre los que se destaca la determinación del índice de acidez para controlar el envejecimiento del petróleo. Esto se realiza, además, con el objetivo de prevenir averías y fugas causadas por la acción del petróleo ácido corrosivo.
- Para la elaboración de distintas medicinas en la industria farmacéutica
Véase también
editarReferencias
editar- ↑ Connors, Kenneth A. (1981). «Cap. 1 Valoraciones ácido-base». Curso de análisis farmacéutico (ensayo del medicamento). Barcelona: Reverte. ISBN 84-291-5127-3.
- ↑ Principios de química. Richard E. Dickerson. Editorial Reverté, 1992. ISBN 8429171754. Pág. 57
- ↑ Tema 12: Valoraciones ácido-base. En: Análisis químico cuantitativo. Daniel C Harris. Editorial Reverté, 2007. ISBN 8429172246. Pág. 224
- ↑ Harris, Daniel C. (1992). Análisis Químico Cuantitativo. Grupo Editorial Iberoamericana. p. 153. ISBN 970-625-003-4.
- ↑ a b Aplicaciones de las valoraciones ácido-base. En: Análisis químico. H. Harris Laitinen, Herbert A. Laitinen. Editorial Reverté, 1982. ISBN 8429173242. Pág. 113
- ↑ a b Valoraciones potenciométricas. Fundamentos de química analítica, Volumen 2. Fundamentos de química analítica. Douglas A. Skoog, Donald M. West, F. James Holler. Editorial Reverté, 1997. ISBN 8429175555. Pág. 432.
- ↑ Valoración conductimétrica de una mezcla de ácidos. Técnicas instrumentales: manual de laboratorio. Sagrario Torres Cartas et al. Ediciones de la Universidad Politécnica de Valencia. Valencia, 2006. ISBN 8497059972. Pág. 26
- ↑ pH-metro con electrodo de vidrio. En: Fisicoquímica para biólogos. J.G. Morris. Editorial Reverté, 2001. ISBN 8429150021. Pág. 361
- ↑ Medical CHEMISTRY Compendium. By Anders Overgaard Pedersen and Henning Nielsen. Aarhus University. 2008
- ↑ Quantitative Chemical Analysis, 7Ed. by Daniel C. Harris. Freeman and Company 2007.
- ↑ Química fotogràfica I: temas 1-6. Joan Torrent Burgués. Escola de Fotografia. Fundació Politècnica de Catalunya, 1994. Pág. 90
- ↑ Fundamentos de química analítica. Douglas A. Skoog, Donald M. West. Cengage Learning Editores, 2005. ISBN 9706863699. Pág. 218
- ↑ Química. American Chemical Society. Pág. 422. Editorial Reverté, 2005. ISBN 8429170014
- ↑ Estandarización de disoluciones valorantes. Archivado el 19 de abril de 2009 en Wayback Machine. José Morillo Aguado. Deptº de Ingeniería Química y Ambiental. Escuela Técnica Superior de Ingenieros de Sevilla. Universidad de Sevilla.
- ↑ Volumetría ácido-base: Análisis de un aceite de oliva. Universidad Miguel Hernández.
Enlaces externos
editar- Cap. 14: Principios de las valoraciones ácido-base. Cap. 15: Curvas de valoración en sistemas ácido-base complejos. Cap. 16: Aplicaciones de las valoraciones ácido-base. En: Fundamentos de química analítica. Douglas A. Skoog, Donald M. West. Cengage Learning Editores, 2005. ISBN 9706863699. Pág. 373-456
- Volumetrías de neutralización. Fundamentos de química analítica: equilibrio iónico y análisis químico. Alfonso Clavijo Díaz. Universidad Nacional de Colombia, 2002.ISBN 9587011430. Pág. 457
- https://www.uv.es/gidprl/practica_Kjeldahl/index.html